题目内容
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验(图1)中的问题.
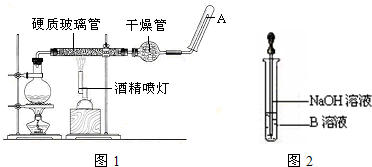
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 .8.4g铁粉参加反应,转移电子 mol.
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 .
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 .
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 .
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是 .用离子方程式表示).
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 .
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+具有 性.由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 .

(1)写出该反应的化学方程式
(2)玻璃管中石棉绒的作用是
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+具有
考点:性质实验方案的设计,铁及其化合物的性质实验
专题:实验设计题
分析:(1)对于铁与水蒸气反应的化学方程式,教材中已出现,很容易写出化学方程式.还原剂的判定方法根据化合价升高的物质,氧化剂是化合价降低的物质;根据3Fe+4H2O(g)
Fe 3O4+4 H2;方程式中反应3mol铁原子转移8个电子;
(2)增大铁粉与水蒸气的接触面;如果在一套装置中需要两处加热,一定要注意点燃加热仪器的顺序,一般是根据实验的安全性和对实验结果的影响来考虑;
(3)反应物为水蒸气与铁;放碎瓷片的目的是防止沸腾事故发生;
(4)KSCN溶液溶液变红色,说明有三价铁离子;溶液未变红色,说明无三价铁离子;
(5)铁单质能将三价铁离子还原成二价铁离子;
(6)滴入NaOH溶液时,生成的白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,则白色沉淀迅速变成灰绿色,最后变成红褐色;
(7)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,Fe能还原Fe3+.
| ||
(2)增大铁粉与水蒸气的接触面;如果在一套装置中需要两处加热,一定要注意点燃加热仪器的顺序,一般是根据实验的安全性和对实验结果的影响来考虑;
(3)反应物为水蒸气与铁;放碎瓷片的目的是防止沸腾事故发生;
(4)KSCN溶液溶液变红色,说明有三价铁离子;溶液未变红色,说明无三价铁离子;
(5)铁单质能将三价铁离子还原成二价铁离子;
(6)滴入NaOH溶液时,生成的白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,则白色沉淀迅速变成灰绿色,最后变成红褐色;
(7)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,Fe能还原Fe3+.
解答:
解:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O
Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;根据3Fe+4H2O(g)
Fe 3O4+4 H2;方程式中反应3mol铁原子转移8个电子,设转移电子物质的量为X,
3Fe~8e-
3×56 8mol
8.4g xmol
=
解得:x=0.4,
故答案为:3Fe+4H2O(g)
Fe 3O4+4 H2;H2O;Fe;0.4;
(2)增大铁粉与水蒸气的接触面;点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,用水蒸气排尽装置中的空气;实验结束时,先熄灭酒精灯,继续通水蒸气防止
故答案为:铁粉的载体,增大铁粉与水蒸气的接触面;酒精灯;酒精喷灯;
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:为实验提供水蒸气;碎瓷片;防止暴沸;
(4)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
故答案为:一定有Fe3O4,可能有Fe;Fe3O4和Fe;
(5)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,所以加硫氰化钾溶液不变红色;
故答案为:Fe+2Fe3+=3Fe2+;
(6)滴入NaOH溶液时,生成的白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,则白色沉淀迅速变成灰绿色,最后变成红褐色,发生的反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(7)一段时间后,发现(4)中未变红的溶液变成红色,是因为空气中的氧气将Fe2+氧化为了Fe3+的原因,在此反应中Fe2+被氧化,体现还原性;Fe2+易被空气中的氧气氧化而变质,所以实验室中含Fe2+的盐溶液现用现配制;为了防止Fe2+被氧化,加铁粉最好,发生反应:Fe+2Fe3+=3Fe2+,不引入新杂质.
故答案为:还原;Fe2+ 易被空气中的氧气氧化而变质;Fe.
| ||
| ||
3Fe~8e-
3×56 8mol
8.4g xmol
| 3×56 |
| 8.4g |
| 8mol |
| xmol |
解得:x=0.4,
故答案为:3Fe+4H2O(g)
| ||
(2)增大铁粉与水蒸气的接触面;点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,用水蒸气排尽装置中的空气;实验结束时,先熄灭酒精灯,继续通水蒸气防止
故答案为:铁粉的载体,增大铁粉与水蒸气的接触面;酒精灯;酒精喷灯;
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:为实验提供水蒸气;碎瓷片;防止暴沸;
(4)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
故答案为:一定有Fe3O4,可能有Fe;Fe3O4和Fe;
(5)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,所以加硫氰化钾溶液不变红色;
故答案为:Fe+2Fe3+=3Fe2+;
(6)滴入NaOH溶液时,生成的白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,则白色沉淀迅速变成灰绿色,最后变成红褐色,发生的反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(7)一段时间后,发现(4)中未变红的溶液变成红色,是因为空气中的氧气将Fe2+氧化为了Fe3+的原因,在此反应中Fe2+被氧化,体现还原性;Fe2+易被空气中的氧气氧化而变质,所以实验室中含Fe2+的盐溶液现用现配制;为了防止Fe2+被氧化,加铁粉最好,发生反应:Fe+2Fe3+=3Fe2+,不引入新杂质.
故答案为:还原;Fe2+ 易被空气中的氧气氧化而变质;Fe.
点评:本题考查了物质的制备、物质成分的探究实验,题目侧重于考查学生的实验探究能力和对基础知识的综合应用能力,注意把握铁及其化合物的性质以及铁离子的检验方法,题目难度中等.

练习册系列答案
相关题目
把镁条放入盛有过量盐酸的试管中,不影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、镁条的表面积 |
| C、加少量Na2SO4固体 |
| D、溶液的温度 |
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
| A、CO2+H2O?H2CO3 | ||||
| B、3NO2+H2O═2HNO3+NO | ||||
C、3Fe+4H2O(g)
| ||||
| D、2Na+2H2O═2NaOH+H2↑ |
近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾(分散质粒子直径在10-9~10-7m)属于下列哪种分散系( )
| A、悬浊液 | B、溶液 |
| C、胶体 | D、乳浊液 |
用于鉴别碳酸氢钠粉末和碳酸钠的实验方法不正确的是( )
| A、加热时有无气体放出 |
| B、滴加盐酸时放出气泡的剧烈程度 |
| C、溶于水后滴加CaCl2稀溶液有无白色沉淀生成 |
| D、溶于水后滴加澄清石灰水有无白色沉淀生成 |