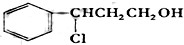题目内容
已知1mol某态烃CmHn完全燃烧时,需要耗氧气5mol;则m与n的下列关系正确的是( )
| A、m=8+n | ||
| B、m=10-n | ||
C、m=5-
| ||
| D、m=12-n |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:1mol某态烃CmHn完全燃烧时,消耗氧气物质的量为:m+
=5,据此解答.
| n |
| 4 |
解答:
解:1mol某态烃CmHn完全燃烧时,消耗氧气物质的量为:m+
=5,故选C.
| n |
| 4 |
点评:本题考查有机物分子式的确定,题目难度不大,注意有机物燃烧的规律,把握有机物的成键特点.

练习册系列答案
相关题目
用于鉴别碳酸氢钠粉末和碳酸钠的实验方法不正确的是( )
| A、加热时有无气体放出 |
| B、滴加盐酸时放出气泡的剧烈程度 |
| C、溶于水后滴加CaCl2稀溶液有无白色沉淀生成 |
| D、溶于水后滴加澄清石灰水有无白色沉淀生成 |
容量瓶上必须标明( )
①温度 ②浓度 ③容量 ④压强 ⑤刻度线.
①温度 ②浓度 ③容量 ④压强 ⑤刻度线.
| A、②③④ | B、①③⑤ | C、③④ | D、③ |
钠用在电光源上做高压灯是因为( )
| A、钠的还原性 |
| B、金属钠燃烧时发出黄色火焰 |
| C、钠光射程远,透雾性强 |
| D、钠熔成小球并在水面四处游动 |
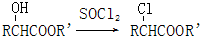 (R,R′代表氢原子或氰基)
(R,R′代表氢原子或氰基) 丙
丙