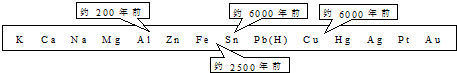
题目内容
下列排序正确的是( )
| A、酸性:H2CO3<C6H5OH<H3COOH |
| B、沸点:PH3<NH3<H2O |
| C、熔点:MgBr2<CCl4<BN |
| D、碱性:Ba(OH)2<Ca(OH)2<KOH |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.苯酚酸性比碳酸弱;
B.水和氨气都含有氢键,沸点较高;
C.SiCl4为分子晶体,熔点最低;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
B.水和氨气都含有氢键,沸点较高;
C.SiCl4为分子晶体,熔点最低;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答:
解:A.C6H5OH酸性比H2CO3弱,向苯酚钠溶液中通入二氧化碳气体,可生成苯酚,酸性应为C6H5OH<H2CO3<H3COOH,故A错误;
B.水和氨气都含有氢键,沸点较高,其中水分子间形成的氢键较多,常温下为液体,而氨气为气体,水的沸点最高,故B正确;
C.CCl4为分子晶体,熔点最低,BN为原子晶体,熔点最高,应有CCl4<MgBr2<BN,故C错误;
D.金属性:K>Ba>Ca,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D错误.
故选:B.
B.水和氨气都含有氢键,沸点较高,其中水分子间形成的氢键较多,常温下为液体,而氨气为气体,水的沸点最高,故B正确;
C.CCl4为分子晶体,熔点最低,BN为原子晶体,熔点最高,应有CCl4<MgBr2<BN,故C错误;
D.金属性:K>Ba>Ca,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D错误.
故选:B.
点评:本题考查较为综合,涉及酸性、金属性、密度以及沸点的比较,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、构成原电池正极和负极的材料必须是金属 |
| B、在原电池中,电子流出的一极是负极,该电极被还原 |
| C、实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 |
| D、原电池可以把物质内部的能量全部转化为电能 |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、萃取操作时,所选萃取剂的密度没有特别限制 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
对下列实验的现象描述正确的是( )

| A、实验①溶液褪色 |
| B、实验③溶液中看到一条光亮的通路 |
| C、实验②溶液褪色 |
| D、实验④饱和碳酸钠溶液下方出现油状液体 |
下列无色溶液中都能大量共存的离子组是( )
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、1mol Cu与足量的该硫酸反应产生2g氢气 |
| C、配制200mL 4.6mol/L的稀硫酸需取该硫酸62.5mL |
| D、等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2mol/L |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283 kJ |
B、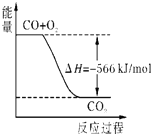 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
下列离子方程式书写正确的是( )
| A、明矾溶液中加入过量的氨水A13++4NH3?H20=AlO2-+4NH4++2H2O | ||
| B、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- | ||
C、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO
| ||
| D、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH+HCO3-=CH3COO-+CO2↑+H2O |