题目内容
下列说法正确的是( )
| A、构成原电池正极和负极的材料必须是金属 |
| B、在原电池中,电子流出的一极是负极,该电极被还原 |
| C、实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 |
| D、原电池可以把物质内部的能量全部转化为电能 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、燃料电池中电极可以是石墨;
B、原电池中负极失电子被氧化;
C、形成原电池能加快反应速率;
D、原电池中化学能除转化为电能外,还有部分转化为热能.
B、原电池中负极失电子被氧化;
C、形成原电池能加快反应速率;
D、原电池中化学能除转化为电能外,还有部分转化为热能.
解答:
解:A、燃料电池中电极可以是石墨,原电池的正极材料也可以选用石墨电极,故A错误;
B、原电池中负极失电子被氧化,正极得电子被还原,故B错误;
C、粗锌与稀硫酸能形成原电池,能加快反应速率,所以实验室欲快速制取氢气,可利用粗锌与稀硫酸反应,故C正确;
D、原电池中化学能除转化为电能外,还有部分转化为热能,原电池的能量转化率小于100%,故D错误.
故选C.
B、原电池中负极失电子被氧化,正极得电子被还原,故B错误;
C、粗锌与稀硫酸能形成原电池,能加快反应速率,所以实验室欲快速制取氢气,可利用粗锌与稀硫酸反应,故C正确;
D、原电池中化学能除转化为电能外,还有部分转化为热能,原电池的能量转化率小于100%,故D错误.
故选C.
点评:本题考查了原电池知识,题目难度不大,侧重于基础知识的考查,注意把握原电池中电极的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解反应通常为吸热反应 |
| D、盐类水解是指组成盐的离子跟水电离出的H+或OH-离子生成弱电解质的反应 |
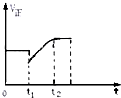 如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A、t1时只减小了压强 |
| B、t1时只降低了温度 |
| C、t1时减小了NH3的浓度,平衡向正反应方向移动 |
| D、t1时减小N2浓度,同时增加了NH3的浓度 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、某种物质溶于水形成酸性溶液,该物质可能是强酸与强碱反应形成的盐 | ||
D、向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中
|
分别用三份10ml0.1mol/L的AgNO3溶液可使体积比为3:2:1 的NaCl、MgCl2、AlCl3三种溶液反应中的氯离子恰好沉淀完全,三种溶液中Cl-的物质的量浓度之比为( )
| A、2:3:6 |
| B、1:2:3 |
| C、3:2:1 |
| D、1:1:1 |
同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是( )
| A、A2B |
| B、AB2 |
| C、BA3 |
| D、B3A |
下列有关常见有机化合物的说法正确的是( )
| A、将一小块金属钠投入无水乙醇中,钠块浮在液面上四处游动 |
| B、NaHCO3溶液可用于区分乙酸、乙醇和苯 |
| C、工业上,用乙醇和浓硫酸共热到170℃制取乙烯 |
| D、天然气的主要成分为甲烷,属于可再生能源 |
下列排序正确的是( )
| A、酸性:H2CO3<C6H5OH<H3COOH |
| B、沸点:PH3<NH3<H2O |
| C、熔点:MgBr2<CCl4<BN |
| D、碱性:Ba(OH)2<Ca(OH)2<KOH |