题目内容
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283 kJ |
B、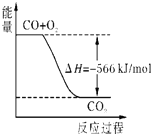 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量以及燃烧热的单位;
B、根据“短线上说明的物质”不仅仅代表的是反应物或者生成物,而其对应的系数代表的是参加反应的物质的量;
C、根据物质由固态变气态吸收热量来解答;
D、依据热化学方程式计算出物质的物质的量,然后根据化合价得出电子转移的数目来解答.
B、根据“短线上说明的物质”不仅仅代表的是反应物或者生成物,而其对应的系数代表的是参加反应的物质的量;
C、根据物质由固态变气态吸收热量来解答;
D、依据热化学方程式计算出物质的物质的量,然后根据化合价得出电子转移的数目来解答.
解答:
解:A、2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量,则一氧化碳的燃烧热为283KJ/mol,题给的单位不对,故A错误;
B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,分析图象中一氧化碳和氧气物质的量为1、
,物质的量不符合反应物质的物质的量,故B错误;
C、2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>-452 kJ/mol,即2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;
D、由2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ/mol,可知2 mol CO2(g)与2 mol Na2O2(s)反应放出452 kJ热量时,消耗2molNa2O2,1个Na2O2发生反应转移的电子数为1个,所以2molNa2O2反应转移电子数是2×6.02×1023=1.204×1024,故D正确;
故选:CD.
B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,分析图象中一氧化碳和氧气物质的量为1、
| 1 |
| 2 |
C、2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>-452 kJ/mol,即2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C正确;
D、由2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ/mol,可知2 mol CO2(g)与2 mol Na2O2(s)反应放出452 kJ热量时,消耗2molNa2O2,1个Na2O2发生反应转移的电子数为1个,所以2molNa2O2反应转移电子数是2×6.02×1023=1.204×1024,故D正确;
故选:CD.
点评:本题主要考查了燃烧热的概念、单位、盖斯定律等知识,试题的综合性较强,有一定的难度.

练习册系列答案
相关题目
下列有关常见有机化合物的说法正确的是( )
| A、将一小块金属钠投入无水乙醇中,钠块浮在液面上四处游动 |
| B、NaHCO3溶液可用于区分乙酸、乙醇和苯 |
| C、工业上,用乙醇和浓硫酸共热到170℃制取乙烯 |
| D、天然气的主要成分为甲烷,属于可再生能源 |
在100mL 0.1mol/L的MgCl2溶液中Cl-的物质的量浓度为( )
| A、0.01mol/L |
| B、0.02mol/L |
| C、0.1 mol/L |
| D、0.2 mol/L |
下列排序正确的是( )
| A、酸性:H2CO3<C6H5OH<H3COOH |
| B、沸点:PH3<NH3<H2O |
| C、熔点:MgBr2<CCl4<BN |
| D、碱性:Ba(OH)2<Ca(OH)2<KOH |
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、1molZn与足量的该硫酸反应产生2g氢气 |
| C、配制200mL4.6mol/L的稀硫酸需取该硫酸500mL |
| D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |
下列物质中既有离子键,又有共价键的是( )
| A、H2O |
| B、CaCl2 |
| C、NH4NO3 |
| D、Cl2 |
有一处于平衡状态的反应:A(g)+3B(s)?2E(g),正反应放热.为使平衡状态向生成E的方向移动,适宜的条件是( )
①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E分离除去.
①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E分离除去.
| A、①③⑥ | B、②③⑥ |
| C、②④⑥ | D、②④⑤⑥ |
1下列有关摩尔质量的描述或应用中,正确的是( )
| A、1 mol OH-的质量为17 g?mol-1 | ||
| B、二氧化碳的摩尔质量为44 g | ||
| C、铁原子的摩尔质量等于它的相对原子质量 | ||
D、一个钠原子的质量等于
|
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.