题目内容
20.应:N2(g)+3H2?2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值;N2和H2的浓度之比始终满足1:3,二者化学计量数为1:3,所以不可能均为0.18mol/L.
解答 解:反应N2(g)+3H2(g)?2NH3(g)为可逆反应,转化率不可能为100%,根据化学计量数及极值法考虑:N2的范围在(0,0.2),H2的范围在(0,0.6),而NH3可以(0,0.4),
A、氨气不可能完全转化,所以氮气浓度小于0.2 mol/L,氢气浓度小于0.6 mol/L,故A错误;
B、氮气的浓度范围为(0,0.2),氮气为0.15mol/L在该范围内,故B正确;
C、N2和H2的浓度之比始终满足1:3,二者化学计量数为1:3,所以不可能均为0.18mol/L,故C错误;
D、氨气的浓度范围为:(0,0.4),氮气和氢气不可能完全转化生成氨气,故D错误;
故选B.
点评 本题考查了可逆反应的特点,题目难度不大,转移明确可逆反应中反应物转化率不可能为100%,该题是高考中的常见题型,注重基础,侧重考查学生分析问题、解决问题的能力.

练习册系列答案
相关题目
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 在常温常压下,11.2 L氧气所含的原子数目为NA | |
| B. | 32 g氧气含的原子数目为NA | |
| C. | 5.6 g铁与足量盐酸反应转移的电子数为0.2NA | |
| D. | 2 L 0.1 mol•L-1 K2SO4溶液中离子总数为1.4 NA |
11.能抑制水的电离,并使溶液中c (H+)>c(OH-)的操作是( )
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通CO2
④向水中通NH3
⑤向水中加NaHSO4固体.
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通CO2
④向水中通NH3
⑤向水中加NaHSO4固体.
| A. | ①③ | B. | ③⑤ | C. | ①②④ | D. | ⑤ |
8.下列反应的离子方程式中,书写正确的是( )
| A. | 实验室用大理石跟稀盐酸制取二氧化碳 2H++CO32-═CO2↑+H2O | |
| B. | 铁跟稀盐酸反应 2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 氢氧化铜跟硫酸溶液反应 H++OH-═H2O | |
| D. | 碳酸氢钠溶液与稀盐酸混合 HCO3-+H+=H2O+CO2↑ |
5.下列离子检验的方法正确的是( )
| A. | 向某溶液中加稀盐酸生成无色气体,说明原溶液中有HCO3- | |
| B. | 向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有CO32- | |
| C. | 向某溶液中加NaOH溶液微热,产生使湿润的红色石蕊试纸变蓝说明原溶液中有NH4+ | |
| D. | 向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有Ba2+ |
12.下列图象表达的化学反应过程中有关物理量的变化符合题意的是( )
| A. | 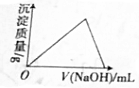 在NH4Al(SO4)2溶液中滴加烧碱溶液 | |
| B. | 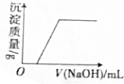 在Ca(HCO3)2溶液中滴加烧碱溶液 | |
| C. | 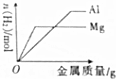 在100mL1mol•L-1盐酸中分别加入足量的镁粉和铝粉 | |
| D. | 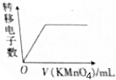 在FeCl2和KI的混合溶液中滴加酸性KMnO4溶液 |
13.下列关于化学键的说法正确的是( )
| A. | 化学键既存在于相邻原子之间,又存在与相邻分子之间 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 相邻原子之间的强相互作用 | |
| D. | 共价键只能存在于共价化合物中 |
14.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、四氯化碳、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 乙酸乙酯、溴苯、乙酸 |