题目内容
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 在常温常压下,11.2 L氧气所含的原子数目为NA | |
| B. | 32 g氧气含的原子数目为NA | |
| C. | 5.6 g铁与足量盐酸反应转移的电子数为0.2NA | |
| D. | 2 L 0.1 mol•L-1 K2SO4溶液中离子总数为1.4 NA |
分析 A、常温常压下气体摩尔体积大于22.4L/mol;
B、氧气由氧原子构成;
C、求出铁的物质的量,然后根据铁和盐酸反应后变为+2价来分析;
D、在硫酸钾溶液中,除了硫酸钾电离出的钾离子和硫酸根外,水还能电离出氢离子和氢氧根.
解答 解:A、常温常压下气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,则原子个数小于NA个,故A错误;
B、氧气由氧原子构成,故32g氧气中含2mol氧原子即2NA个,故B错误;
C、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故0.1mol铁失去0.2NA个电子,故C正确;
D、在硫酸钾溶液中,除了硫酸钾电离出的钾离子和硫酸根外,水还能电离出氢离子和氢氧根,故溶液中的离子总数大于0.6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列叙述中正确的是( )
| A. | 仅由碳元素组成的物质一定是纯净物 | |
| B. | C60是碳的一种同素异形体 | |
| C. | C60的摩尔质量是720g | |
| D. | 石墨转变为金刚石不属于化学变化 |
1.除去括号中的杂质,填写涉及的离子反应方程式或化学方程式.
| 编号 | 混合物 | 方程式 |
| ① | 溶液:FeCl2 (FeCl3) | |
| ② | 固体:SiO2 (CaCO3) | |
| ③ | 气体:CO2 (HCl) | |
| ④ | 固体:NaCl(NH4Cl) |
18.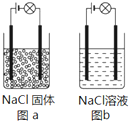 某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
 某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在在电流作用下电离成Na+和Cl- | |
| D. | NaCl溶液中存在大量可自由移动的离子 |
2.下列食物中,属于酸性食物的是( )
| A. | 葡萄 | B. | 牛奶 | C. | 奶油 | D. | 鸡蛋 |
19.在同温同压下,A容器的H2和B容器的NH3,若所含氢原子数目之比为2:3,则这两个容器的体积比是( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
20.应:N2(g)+3H2?2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
 国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:
国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空: