题目内容
8.下列反应的离子方程式中,书写正确的是( )| A. | 实验室用大理石跟稀盐酸制取二氧化碳 2H++CO32-═CO2↑+H2O | |
| B. | 铁跟稀盐酸反应 2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 氢氧化铜跟硫酸溶液反应 H++OH-═H2O | |
| D. | 碳酸氢钠溶液与稀盐酸混合 HCO3-+H+=H2O+CO2↑ |
分析 A.碳酸钙在离子反应中保留化学式;
B.反应生成氯化亚铁、氢气;
C.氢氧化铜在离子反应中保留化学式;
D.反应生成氯化钠、水、二氧化碳.
解答 解:A.实验室用大理石跟稀盐酸制取二氧化碳的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故A错误;
B.铁跟稀盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.氢氧化铜跟硫酸溶液反应的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.碳酸氢钠溶液与稀盐酸混合的离子反应为HCO3-+H+=H2O+CO2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
18.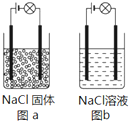 某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
 某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在在电流作用下电离成Na+和Cl- | |
| D. | NaCl溶液中存在大量可自由移动的离子 |
19.在同温同压下,A容器的H2和B容器的NH3,若所含氢原子数目之比为2:3,则这两个容器的体积比是( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在同温同压时,相同体积的任何气体单质所含的分子数目相同 | |
| B. | 2g氢气所含原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| D. | 17g氨气所含氢原子数目为NA |
3.在某溶液中仅存在Na+、Fe3+、SO42-三种离子,已知Na+和SO42-个数比为3:2,则Na+、Fe3+、SO42-三种离子的个数比为( )
| A. | 9:1:6 | B. | 3:1:2 | C. | 3:2:2 | D. | 9:2:6 |
13.现有下列4组物质:
A. CaO、MgO、CO2、CuO
B.H2、Cl2、N2、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)填写下表空白
(2)若(1)表中的4种物质相互作用可生成一种新物质--碱式碳酸铜[化学式为Cu2(OH)2CO3],请写出该反应的化学方程式:2Cu+O2+CO2+H2O═Cu2(OH)2CO3.
A. CaO、MgO、CO2、CuO
B.H2、Cl2、N2、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)填写下表空白
| A组 | B组 | C组 | D组 | |
| 分类标准 | 金属氧化物 | 金属单质 | ||
| 不属于该类别的物质 | Cu | H2O |
20.应:N2(g)+3H2?2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
1.设NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1 mol Na2O2与足量CO2反应后转移的电子数为NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2 NA | |
| C. | 常温常压下,11.2 L CH4中含有的氢原子数为2 NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2 NA |
2.下列说法正确的是( )
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 1mol H2的质量是1g,它所占的体积是22.4L | |
| C. | 在标准状况下,1mol任何气体所占的体积都约为22.4L•mol-1 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |