题目内容
15.下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:(1)所需浓H2SO4的体积为13.6mL(用下一小题的仪器量取).
(2)如果实验室有15mL、20mL、50mL量筒,应选用20mL量筒最好.
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌.
(4)将冷却至室温的上述溶液沿玻璃棒注入500容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀.
(5)加水至距刻度1-2cm时,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平.
(6)误差分析:请用“偏高”“偏低”或“无影响”进行填空
①定容时,观察液面俯视:偏高
②摇匀后,液面低于刻度线,没有再加水:无影响.
分析 (1)浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(4)根据移液的操作方法来分析;
(5)定容时,要用胶头滴管来滴加;
(6)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,
设需要的浓硫酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=0.5mol/L×500mL
解得V=13.6mL,故答案为:13.6;
(2)需要的浓硫酸的体积为13.6ml,根据“大而近”的原则,故选择20ml的量筒,故答案为:20;
(4)移液时,是将冷却至室温的上述溶液沿玻璃棒注入500ml容量瓶中,
故答案为:玻璃棒;500容量瓶;
(5)定容时,开始时直接向容量瓶中加水,加水至距刻度线1-2cm时,改用胶头滴管逐滴加入,使溶液凹液面跟刻度相平,
故答案为:1-2cm;
(6)①定容时,观察液面俯视,会导致溶液体积偏小,则浓度偏高,故答案为:偏高;
②摇匀后,液面低于刻度线是正常的,没有再加水正确的,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大.

练习册系列答案
相关题目
3.在某溶液中仅存在Na+、Fe3+、SO42-三种离子,已知Na+和SO42-个数比为3:2,则Na+、Fe3+、SO42-三种离子的个数比为( )
| A. | 9:1:6 | B. | 3:1:2 | C. | 3:2:2 | D. | 9:2:6 |
10.下列叙述中,正确的是( )
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 化合物变为单质时,化合价变化的元素一定被还原 | |
| D. | 油锅着火时,立即用水扑灭 |
20.应:N2(g)+3H2?2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
7. 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制氧气 |
8. 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会偏高(填偏高、偏低、或不变),其原因是由于浓硫酸溶于水放热.
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).
9.根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如表:
①元素Y的氢化物的电子式为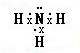 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
②元素Z与元素T相比,非金属性较强的是Cl(填元素符号).
③探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的最外层电子数(填字母)b.
②第三周期元素的最高化合价(填字母)c.
③N3-、O2-、F-、Na+、Mg2+、Al3+的离子半径(填字母)a.
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
①氢化物的易燃性:第二周期CH4>NH3>H2O>HF;
第三周期SiH4>PH3>H2S>HCl(填化学式).
②化合物的毒性:PH3>NH3,H2S>H2O.CS2>CO2,(选填>、<或=).
(1)现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
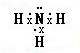 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.②元素Z与元素T相比,非金属性较强的是Cl(填元素符号).
③探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的最外层电子数(填字母)b.
②第三周期元素的最高化合价(填字母)c.
③N3-、O2-、F-、Na+、Mg2+、Al3+的离子半径(填字母)a.
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
①氢化物的易燃性:第二周期CH4>NH3>H2O>HF;
第三周期SiH4>PH3>H2S>HCl(填化学式).
②化合物的毒性:PH3>NH3,H2S>H2O.CS2>CO2,(选填>、<或=).
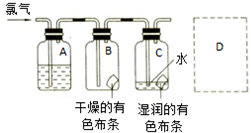 国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:
国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空: