题目内容
12.下列图象表达的化学反应过程中有关物理量的变化符合题意的是( )| A. | 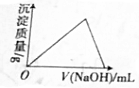 在NH4Al(SO4)2溶液中滴加烧碱溶液 | |
| B. | 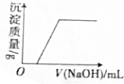 在Ca(HCO3)2溶液中滴加烧碱溶液 | |
| C. | 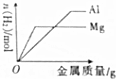 在100mL1mol•L-1盐酸中分别加入足量的镁粉和铝粉 | |
| D. | 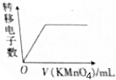 在FeCl2和KI的混合溶液中滴加酸性KMnO4溶液 |
分析 A.在NH4Al(SO4)2溶液中滴加烧碱溶液,开始铝离子与氢氧根离子生成氢氧化铝沉淀,然后铵根离子与氢氧根离子反应生成NH3•H2O,最后阶段氢氧化铝沉淀溶解;
B.在Ca(HCO3)2溶液中滴加烧碱溶液一开始就有沉淀生成;
C.在100mL1mol•L-1盐酸中分别加入足量的镁粉和铝粉反应,酸中的氢离子全部转化为氢气;
D.FeCl2和KI的混合溶液中滴加酸性KMnO4溶液,Fe2+和I-失电子,KMnO4得电子.
解答 解:A.在NH4Al(SO4)2溶液中滴加烧碱溶液,开始铝离子与氢氧根离子生成氢氧化铝沉淀,沉淀质量逐渐增大,铝离子全部反应后,铵根离子与氢氧根离子反应生成NH3•H2O,沉淀的质量不变,铵根离子全部反应后,氢氧化铝沉淀与氢氧化钠反应,沉淀完全溶解,图象不符合,故A错误;
B.在Ca(HCO3)2溶液中滴加烧碱溶液一开始就有沉淀生成,其反应为:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O,图象不符合,故B错误;
C.在100mL1mol•L-1盐酸中分别加入足量的镁粉和铝粉反应,由于Mg的活泼性比Al强,所以Mg的反应速率快,金属过量,酸中的氢离子全部转化为氢气,所以生成的氢气体积相同,图象不符合,故C错误;
D.FeCl2和KI的混合溶液中滴加酸性KMnO4溶液,Fe2+和I-失电子,KMnO4得电子,随着酸性KMnO4溶液的加入,转移的电子的物质的量逐渐大,当Fe2+和I-完全反应后,转移电子不再改变,故D正确.
故选D.
点评 本题考查了元素化合物的性质、氧化还原反应、图象的分析,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
2.下列食物中,属于酸性食物的是( )
| A. | 葡萄 | B. | 牛奶 | C. | 奶油 | D. | 鸡蛋 |
3.在某溶液中仅存在Na+、Fe3+、SO42-三种离子,已知Na+和SO42-个数比为3:2,则Na+、Fe3+、SO42-三种离子的个数比为( )
| A. | 9:1:6 | B. | 3:1:2 | C. | 3:2:2 | D. | 9:2:6 |
20.应:N2(g)+3H2?2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
7. 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制氧气 |
1.设NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1 mol Na2O2与足量CO2反应后转移的电子数为NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2 NA | |
| C. | 常温常压下,11.2 L CH4中含有的氢原子数为2 NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2 NA |
8. 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会偏高(填偏高、偏低、或不变),其原因是由于浓硫酸溶于水放热.
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).
5.自然环境与人们的生活息息相关.下列有关环境问题的说法不正确的是( )
| A. | 氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” | |
| B. | 将垃圾分类并回收利用是垃圾处理的发展方向 | |
| C. | 废旧电池的回收,其主要目的是保护环境,而不是回收金属 | |
| D. | 淀粉餐具被认为是有发展前景的一次性餐具,可有利于保护环境 |
6.化学与生活、社会密切相关,下列说法正确的是( )
| A. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| B. | 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 | |
| C. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| D. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 |