题目内容
7.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的△H=2×(-57.3)kJ•mol-1 |
分析 A.燃烧热中水为液态;
B.合成氨为可逆反应,而热化学方程式中为完全转化时的能量变化;
C.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,即1molH2完全燃烧生成液态水,放出285.8 kJ热量;
D.中和反应为放热反应,且生成硫酸钙放热.
解答 解:A.甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.合成氨为可逆反应,而热化学方程式中为完全转化时的能量变化,则将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1,故B错误;
C.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,即1molH2完全燃烧生成液态水,放出285.8 kJ热量,且物质的量与热量成正比,可知氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故C正确;
D.中和反应为放热反应,且生成硫酸钙放热,则H2SO4和Ca(OH)2反应的△H<2×(-57.3)kJ•mol-1,故D错误;
故选C.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意物质的状态及焓变的正负,选项B为解答的难点,题目难度不大.

练习册系列答案
相关题目
9.下列化学用语正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0 | |
| D. | 碳在高温下还原二氧化硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
10.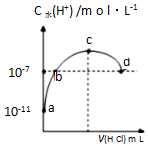 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |
7.氯碱工业是一种高能耗产业,下图表示的是电解池与燃料电池相组合的一种节能新工艺.图中电极末画出,只显示了相关物料的传输和转化关系.下列有关该工艺流程的分析正确的是( )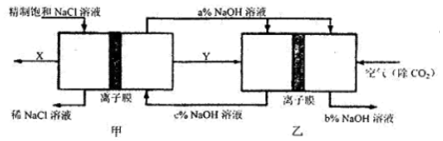

| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
2.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的表现 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
16.氢气、铝、铁都是重要的还原剂.已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1
3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5.
2H2(g)+O2(g)=2H2O(g)△H1
3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5.
| A. | △H1<0△H3>0 | B. | △H5<0△H4<△H3 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
17.下列化学用语正确的是( )
| A. | 次氯酸分子的电子式 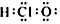 | B. | CH4Si的结构式 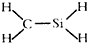 | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型  |