题目内容
14.在水溶液中能大量共存,加入过量的稀H2SO4后有沉淀和气体产生的组含有的离子是( )| A. | HCO3-,Cl-,Na+,NH4+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,CO32-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
分析 A.四种离子能够共存,但是加入氯水后没有沉淀生成;
B.加入过量硫酸后没有沉淀生成;
C.加入硫酸后,硅酸根离子与氢离子生成硅酸沉淀,碳酸根离子与氢离子反应生成二氧化碳气体;
D.四种离子之间不反应,加入硫酸后不会生成气体.
解答 解:A.HCO3-、Cl-、Na+、NH4+之间不反应,加入硫酸后生成二氧化碳气体,但是没有沉淀生成,故A错误;
B.AlO2-、S2-、Na+、K+之间不反应,加入硫酸后生成硫化氢气体,但是加入过量硫酸后不会生成沉淀,故B错误;
C.SiO32-、CO32-、K+、Na+之间能够共存,SiO32-与过量硫酸反应生成硅酸沉淀,CO32-与硫酸反应生成二氧化碳气体,满足条件,故C正确;
D.Ba2+、Al3+、NO3-、Cl-之间不反应,加入硫酸后生成硫酸钡沉淀,但是不会生成气体,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:“加入过量的稀H2SO4后有沉淀和气体产生”,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
5.将pH为3的醋酸溶液加水稀释1000倍,稀释后溶液的pH为( )
| A. | 等于6 | B. | 大于6 | C. | 小于6 | D. | 等于0 |
2.有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
(1)写出下列元素名称:AHBNaCODAlEClFS.
(2)写出元素C的离子结构示意图 .
.
(3)D、E、F的简单离子半径由大到小的顺序是S2->Cl->Al3+.
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为 .
.
(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为H-O-Cl.
(6)D与E形成的化合物的类别是共价化合物(填共价化合物或离子化合物).
(7)能证明C的非金属性比F强的实验事实是水比硫化氢稳定.
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)写出元素C的离子结构示意图
 .
.(3)D、E、F的简单离子半径由大到小的顺序是S2->Cl->Al3+.
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为
 .
.(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为H-O-Cl.
(6)D与E形成的化合物的类别是共价化合物(填共价化合物或离子化合物).
(7)能证明C的非金属性比F强的实验事实是水比硫化氢稳定.
19.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.图为N2(g)和O2(g)生成NO(g)过程中的能量变化

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
6.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( ) 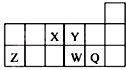

| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| C. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 | |
| D. | 元素Y的单质比元素X的单质更容易与氢气反应 |
3.用聚光手电筒照射下列分散系,不能观察到丁达尔效应的是( )
| A. | 淀粉溶液 | B. | Fe(OH)3胶体 | C. | 鸡蛋清溶液 | D. | 葡萄糖溶液 |
4.松花蛋,又称皮蛋.其中一种加工工艺的主要原料配方为:将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.
请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
(5)皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是发生酸碱中和反应.
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.
请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
| 实验步骤 | 实验现象 |
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.