题目内容
12.将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2 mol/L.已知硫酸浓度越大,密度越大,则c1 与c2的数值关系是( )| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
分析 溶质的质量分数变为2a%,则溶液的质量减小一半,硫酸溶液的浓度越大,密度越大,则蒸发后溶液的体积小于原来的一半,根据溶液蒸发前后溶质的物质的量不变计算.
解答 解:质量分数由a→2a%,即蒸发的水的质量为原溶液的一半,设原溶液1 L,
则n(H2SO4)=1 L×c1 mol•L-1=c1 mol,
设溶液的质量为1000ρ1,蒸发掉水后,溶液质量为$\frac{1000{ρ}_{1}}{2}$,
蒸发后溶液的体积为$\frac{\frac{1000{ρ}_{1}}{2}}{{ρ}_{2}}$=$\frac{{ρ}_{1}}{2{ρ}_{2}}$L,
所以c2=$\frac{n}{V}$=$\frac{{c}_{1}}{\frac{{ρ}_{1}}{2{ρ}_{2}}}$mol/L=2c1•$\frac{{ρ}_{2}}{{ρ}_{1}}$,
而ρ2>ρ1,
则c2>2c1,
故选C.
点评 本题考查物质的量浓度的计算,侧重考查学生分析计算能力,注意蒸发前后溶质的物质的量不变、以及溶液密度的变化,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
2.电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10mol∕L Ag+ | B. | 0.20mol∕L Cu2+ | C. | 0.20mol∕L Zn2+ | D. | 0.20mol∕LPb2+ |
3.煤在燃烧时会产生SO2,造成环境污染.下列说法不正确的有( )
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 | |
| D. | 往燃煤中混入生石灰,可减少SO2排放 |
20.下列各组离子一定能大量共存的是( )
| A. | 含有大量Ba2+的溶液:Cl- K+ SO42- CO32- | |
| B. | 含有大量H+的溶液:Mg2+ Na+ SO42- CO32- | |
| C. | 含有大量 OH-的溶液:Cu2+ NO3- SO42- CO32- | |
| D. | 含有大量Na+的溶液:H+ K+ SO42- NO3- |
7.汽车尾气和燃煤造成空气污染.
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
写出该反应平衡常数表达式:K=$\frac{c(C{H}_{3}OC{H}_{3}){c}^{2}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$.
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
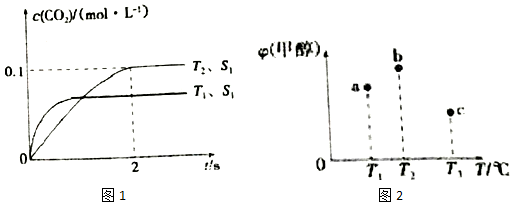
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
达到平衡时CO的转化率为45%.

(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
4.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少里乙烯的最佳方法是( )
| A. | 混合气体通过盛有水的洗气瓶 | |
| B. | 通过装有过量浓溴水的洗气瓶 | |
| C. | 先将混合气体通过酸性高锰酸钾溶液中,然后再通入NaOH溶液中 | |
| D. | 混合气与过量氢气混合 |
1.下列有关化学用语使用正确的是( )
| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
 .
.