题目内容
1.下列有关化学用语使用正确的是( )| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
分析 A、34S2-的核外有18个电子,核内有16个质子;
B、双氧水为共价化合物;
C、 为甲烷的球棍模型;
为甲烷的球棍模型;
D、元素符号左下角数字表示质子数、左上角数字表示质量数.
解答 解:A、34S2-的核外有18个电子,核内有16个质子,故离子结构示意图为 ,故A正确;
,故A正确;
B、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故B错误;
,故B错误;
C、甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故C错误;
,故C错误;
D、元素符号左下角数字表示质子数、左上角数字表示质量数,所以中子数为18的硫原子质量数为34,表示为:3416S,故D错误.
故选A.
点评 本题考查了化学用语,涉及电子式、结构示意图等,还常常考查结构式、实验式、核外电子排布式、比例模型、球棍模型等化学用语,注意化学用语的规范性,题目难度不大.

练习册系列答案
相关题目
11.海带中碘元素的检验可经过以下四个步骤完成(已知H2O2在酸性条件下能将海带中的I?氧化成I2,I2遇淀粉变蓝),各步骤中选用的实验用品不正确的是( )


| A. | 将海带剪碎后灼烧成灰,选用①、②和⑨ | |
| B. | 将海带灰加蒸馏水溶解,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 取滤液,先加入几滴稀硫酸,再滴加H2O2,最后滴加淀粉溶液,选用③和⑩ |
12.将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2 mol/L.已知硫酸浓度越大,密度越大,则c1 与c2的数值关系是( )
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
9.下列关于电解质的说法正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 在稀的水溶液中,强电解质近乎全部以离子的形态存在,一定不存在电解质分子 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化介物 |
16.下列反应中,氧化剂与还原剂物质的量的关系不是1:2的是( )
| A. | 3S+6NaOH═Na2SO3+2Na2S+3H2O | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | 2FeCl2+Cl2=3FeCl3 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
6.将1.85g含锌、铁、铜的合金放入足量的盐酸中,反应完毕后,得448mL(标况)氢气,关于此合金的组成,下列说法中不正确的是( )
| A. | 合金中铁、锌的物质的量之和为0.02mol | |
| B. | 合金中铜的质量无法确定 | |
| C. | 合金中铁、铜的物质的量之和为0.01mol | |
| D. | 1.30g>铁和锌质量之和>1.12g |
13.氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备流程图如图:
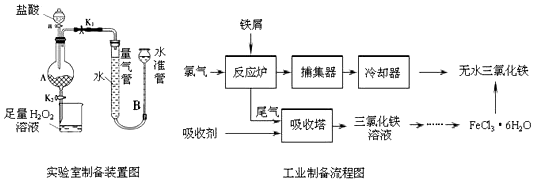
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如表:
实验室制备操作步骤如下:
Ⅰ打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ当装置A中不产生气泡或量气管和水准管液面不变时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定过程中可能造成实验结果偏低的是BC
A.锥形瓶未润洗 B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡 D.滴定终点时仰视读数
②$\frac{162.5cV}{m}%$样品中氯化铁的质量分数.

已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如表:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ当装置A中不产生气泡或量气管和水准管液面不变时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定过程中可能造成实验结果偏低的是BC
A.锥形瓶未润洗 B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡 D.滴定终点时仰视读数
②$\frac{162.5cV}{m}%$样品中氯化铁的质量分数.
4.下列有关化学用语表示正确的是( )
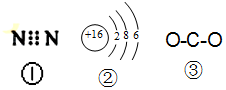

| A. | 图中的①是N2的电子式 | |
| B. | 图中的②是S2-的结构示意图 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | 图 ③为CO2的结构式 |
