题目内容
2.电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )| A. | 0.10mol∕L Ag+ | B. | 0.20mol∕L Cu2+ | C. | 0.20mol∕L Zn2+ | D. | 0.20mol∕LPb2+ |
分析 在电解池中,阴极上阳离子的放电顺序是:银离子>铜离子>氢离子,只有放电顺序在H+前的才析出金属,根据电极反应结合电子守恒来计算即可.
解答 解:Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,而含有银离子和铜离子这两种阳离子的盐溶液中,Ag和Cu金属先在阴极析出.
A、0.10mol∕LAg+在氢离子之前放电,金属银的质量是 0.1mol/L×0.1L×108g/mol=1.08g;
B、铜离子先放电,100mL0.20mol∕LCu2+就会得到0.04mol电子,所以析出金属铜的质量为$\frac{1}{2}$×0.04mol×64g/mol=1.28g;
C、Zn2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
D、Pb2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属.
所以析出金属质量最大的是0.20mol∕LCu2+.
故选B.
点评 本题考查学生电解池上阴极上离子的放电顺序并结合电子守恒来计算析出金属的质量,综合性较强,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列离子方程式中,正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | Y既可是金属也可是非金属 | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | X、Z形成的某化合物在熔融状态下不导电 | |
| D. | WY2分子中既有非极性键又有极性键 |
7.关于电解质溶液的正确判断是( )
| A. | 在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以共存 | |
| B. | 水电离的c(H+)=1×10-3mol/L的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | 由0.l moI/L BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | $\frac{{K}_{W}}{(O{H}^{-})}$=1×10-13mol/L 的溶液中:Ba2+、ClO-、Cl-、NO3- |
14.不能用有关胶体的观点解释的现象是( )
| A. | 在NaCl溶液中滴入AgNO3溶液有沉淀 | |
| B. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 | |
| C. | 在河流入海口易形成三角洲 | |
| D. | 在实验中不慎手被玻璃划破,可用FeCl3溶液应急止血 |
11.海带中碘元素的检验可经过以下四个步骤完成(已知H2O2在酸性条件下能将海带中的I?氧化成I2,I2遇淀粉变蓝),各步骤中选用的实验用品不正确的是( )


| A. | 将海带剪碎后灼烧成灰,选用①、②和⑨ | |
| B. | 将海带灰加蒸馏水溶解,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 取滤液,先加入几滴稀硫酸,再滴加H2O2,最后滴加淀粉溶液,选用③和⑩ |
12.将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2 mol/L.已知硫酸浓度越大,密度越大,则c1 与c2的数值关系是( )
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
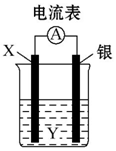 依据2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题: