题目内容
9.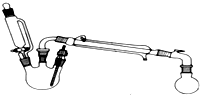 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
回答下列问题:
(1)制取乙酸乙酯化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)浓硫酸与醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(5)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示)不能;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
分析 (1)利用乙酸与乙醇发生酯化反应制备乙酸乙酯;
(2)先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加,使产生的热量及时散失;
(3)如果加热一段时间后发现忘记加瓷片,应冷却后加入;
(4)控制滴加乙酸和乙醇混和液的速度是为让乙醇和乙酸尽可能多的反应,提高转化率;
(5)蒸出的粗乙酸乙酯中含有未反应完的乙醇,乙酸以及生成的水,还有副反应产生的乙醚;
(6)饱和的Na2CO3溶液洗涤除去乙酸,不能换成氢氧化钠,因为氢氧化钠会导致生成的乙酸乙酯水解;用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,主要是为降低乙酸乙酯的溶解度.
解答 解:(1)制取乙酸乙酯化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)浓硫酸与醇混合方法为先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加,因为浓硫酸稀释会放出大量的热,防止液滴飞溅,
故答案为:先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加;
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是待冷却后加入,故答案为:B;
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是为让乙醇和乙酸尽可能多的反应,提高转化率,
故答案为:保证乙醇量是乙酸量10倍以上,提高乙酸的转化率;
(5)蒸出的粗乙酸乙酯中含有未反应玩的乙醇,乙酸以及生成的水.还有副反应产生的乙醚,
故答案为:乙醚、乙酸、乙醇和水;
(6)饱和的Na2CO3溶液洗涤除去乙酸,不能换成氢氧化钠,因为氢氧化钠会导致生成的乙酸乙酯水解.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,主要是为降低乙酸乙酯的溶解度,故答案为:不能;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH;减少乙酸乙酯溶解.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、实验技能、有机物的结构与性质等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
| A. | Al3+、Ag+、NO3-、I- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | NH4+、K+、S2-、Br- | D. | Zn2+、Na+、NO3-、SO42- |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0