题目内容
4. 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0①下列方法中可以使0.10mol•L-1 CH3COOH的电离程度增大的是bcf
a.加入少量0.10mol•L-1稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol•L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol•L-1 NaOH溶液
②将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)小于V(醋酸)(填“大于”、“小于”或“等于”)
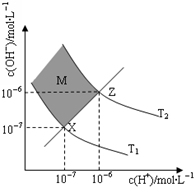
③右图表示溶液中c(H+)和c(OH-)的关系,M区域内(阴影部分)任意点c(H+)小于c(OH-)(填“大于”、“小于”或“等于”)
④在T2温度下,将pH=9NaOH溶液与pH=4HCl溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与HCl溶液的体积比为1:9.(混合后溶液体积的变化忽略不计)
分析 ①醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
②生成氢气的体积取决于电离出的氢离子的量的多少;
③在XZ线上的点,c(H+)=c(OH-),XZ线以上的区域c(H+)<c(OH-);
④根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和HCl溶液的体积.
解答 解:(1)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:bcf;
②醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,等体积且pH均等于3的醋酸和盐酸溶液中,醋酸的浓度大,所以醋酸产生的氢气体积较大
故答案为:小于;
③在XZ线上的点,c(H+)=c(OH-),XZ线以上的区域c(H+)<c(OH-),即M区域内(阴影部分)任意点c(H+)小于c(OH-),故答案为:小于;
④T℃时水的d离子积为10-12,所得混合溶液的pH=7,溶液呈碱性,氢氧根离子浓度为10-5mol/L,则$\frac{V(NaOH)×1{0}^{-3}-V(HCl)×1{0}^{-4}}{V(NaOH)+V(HCl)}$=10-5mol/L,解得V(NaOH):V(HCl)=1:9,
故答案为:1:9.
点评 本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键,侧重于考查学生的分析能力和计算能力.

①HA+HC2-(少量)═A-+H2C-;
②H2B(少量)+2A-═B2-+2HA;
③H2B(少量)+H2C-═HB-+H3C.
下列离子方程式不能发生的是( )
| A. | HB-+A-═HA+B2- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | H3C+3OH-═3H2O+C3- |
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
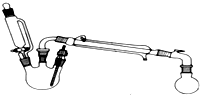 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
回答下列问题:
(1)制取乙酸乙酯化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)浓硫酸与醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(5)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示)不能;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、托盘天平、胶头滴管、1000 mL容量瓶.(在横线上填写所缺仪器的名称)需要高锰酸钾0.004mol
(3)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.024 mol/L.
 O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为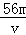 mol/L B.
mol/L B.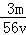 mol/L C.
mol/L C.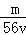 mol/L D.
mol/L D. mol/L
mol/L