题目内容
16.对SO2与SO3说法正确的是( )| A. | 都是直线形结构 | |
| B. | 中心原子都采取sp3杂化轨道 | |
| C. | SO2中S原子和SO3中S原子上都没有孤对电子 | |
| D. | SO2为V形结构,SO3为平面三角形结构 |
分析 A.先计算分子的价层电子对,再根据价层电子对互斥理论确定分子的空间结构;
B.先计算分子的价层电子对,再根据价层电子对互斥理论确定原子的杂化方式;
C.根据$\frac{1}{2}$(a-xb)计算中心原子的孤对电子个数;
D.先计算分子的价层电子对,再根据价层电子对互斥理论确定分子的空间结构.
解答 解:A.SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,该分子为V形结构,SO3 分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,为平面三角形结构,故A错误;
B.SO2的价层电子对个数是3,所以硫原子采取SP2杂化,SO3的价层电子对个数是3,所以硫原子采取sp2杂化,故B错误;
C.SO2的孤电子对个数=$\frac{1}{2}$(6-2×2)=1,SO3的孤电子对个数=$\frac{1}{2}$(6-3×2)=0,二氧化硫有1对孤对电子,三氧化硫没有孤对电子,故C错误;
D.SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,该分子为V形结构,SO3分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,为平面三角形结构,故D正确;
故选D.
点评 本题考查了原子的杂化方式、分子的空间构型的判断等知识点,难度不大,注意原子的杂化方式的判断、分子空间构型的判断是高考的热点,是学习的重点.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
6.下列说法正确的是( )
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 热化学方程式的计量数可以表示分子的个数 |
7.苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是( )
①苯能使溴水萃取分层
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等.
①苯能使溴水萃取分层
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等.
| A. | ④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | ②④⑤ |
11.将pH=8的氢氧化钠溶液和pH=10的氢氧化钠溶液等体积混合后,溶液中的C(H+)最接近( )
| A. | $\frac{{{{10}^{-8}}+{{10}^{-10}}}}{2}mol/L$ | B. | $\frac{{{{10}^{-6}}+{{10}^{-4}}}}{2}mol/L$ | ||
| C. | (10-8+10-10)mol/L | D. | 2×10-10mol/L |
1. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A. | X的最高价氧化物能不溶于强碱 | B. | 非金属性:T<R | ||
| C. | 气态氢化物稳定性:T>Z | D. | R与Q的原子核外电子数相差16 |
8.下列说法不正确的是( )
| A. | 油脂水解的产物是高级脂肪酸和丙三醇 | |
| B. | 油脂属于混合物 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
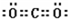 共价键;
共价键;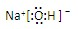 ,离子键,共价键;
,离子键,共价键; ,共价键;
,共价键;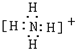 ,共价键.
,共价键.