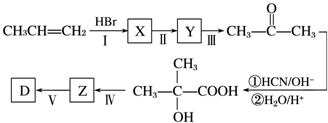
题目内容
1. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A. | X的最高价氧化物能不溶于强碱 | B. | 非金属性:T<R | ||
| C. | 气态氢化物稳定性:T>Z | D. | R与Q的原子核外电子数相差16 |
分析 由元素R、X、T、Z、Q在元素周期表中的相对位置,其中只有X是短周期的金属元素,可知X为Al、R为C、T为Si、Q为Ge、Z为P.
A.氧化铝属于两性氧化物;
B.同主族自上而下非金属性减弱;
C.元素非金属性越强,对应氢化物越稳定;
D.R与Q的原子序数之差为第三、第四周期容纳元素种数之和,核外电子数之差等于其原子序数之差.
解答 解:由元素R、X、T、Z、Q在元素周期表中的相对位置,其中只有X是短周期的金属元素,可知X为Al、R为C、T为Si、Q为Ge、Z为P.
A.氧化铝属于两性氧化物,能溶于强酸、强碱,故A错误;
B.同主族自上而下非金属性减弱,故非金属性:T<R,故B正确;
C.非金属性T<Z,元素非金属性越强,对应氢化物越稳定,故C错误;
D.R与Q的原子序数之差为第三、第四周期容纳元素种数之和,即R与Q的原子核外电子数相差8+18=26,故D错误.
故选:B.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表的结构,注意了解同主族原子序数关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
12.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
9.含硫酸的三氧化铬(CrO3)遇酒精(C2H5OH)后,其颜色会从红色变成蓝绿色,利用这个现象可判断汽车司机是否酒后驾车,反应式为:2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O,此反应中,硫酸作( )
| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
16.对SO2与SO3说法正确的是( )
| A. | 都是直线形结构 | |
| B. | 中心原子都采取sp3杂化轨道 | |
| C. | SO2中S原子和SO3中S原子上都没有孤对电子 | |
| D. | SO2为V形结构,SO3为平面三角形结构 |
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用苯萃取溴水时有机层应从下口放出 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
10. 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )| A. | 该物质的分子式为S4N4 | |
| B. | 该物质的分子中既有极性键又有非极性键 | |
| C. | 该物质的分子中N、S原子均采取sp3杂化 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
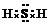 .
.
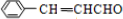 ;
;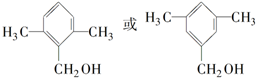 ;
;