题目内容
8g氧气为 mol,0.1mol氧分子共有 mol电子,在标准状况下,1mol气体的体积约为 L.
考点:物质的量的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据n=
=
结合物质的构成计算.
| m |
| M |
| V |
| Vm |
解答:
解:n(O2)=
=0.25mol,
已知1个O2分子中含有16g 电子,则0.1mol氧分子共有1.6mol电子,
V(O2)=1mol×22.4L/mol=22.4L,
故答案为:0.25;1.6;22.4.
| 8g |
| 32g/mol |
已知1个O2分子中含有16g 电子,则0.1mol氧分子共有1.6mol电子,
V(O2)=1mol×22.4L/mol=22.4L,
故答案为:0.25;1.6;22.4.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式、单位以及概念的理解和运用.

练习册系列答案
相关题目
下列离子反应方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、氢氧化铜和稀盐酸溶液反应:H++OH-═H2O |
| C、锌粒溶于醋酸溶液:Zn+2H+═Zn2++H2↑ |
| D、往盐酸中滴加少量Na2CO3溶液:CO32-+2H+═CO2↑+H2O |
下列实验设计能够成功的是( )
A、检验亚硫酸钠试样是否变质:试样
| ||||||||
B、检验某卤代烃是否是氯代烃:试样
| ||||||||
C、证明酸性条件H2O2氧化性比I2强:NaI溶液
| ||||||||
D、除去氯化钠晶体中少量硝酸钾:试样
|

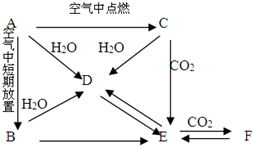 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.