题目内容
按要求书写方程式
①NH3?H2O在水中的电离方程式: ;
②Na2HPO4溶于水的电离方程式: .
①NH3?H2O在水中的电离方程式:
②Na2HPO4溶于水的电离方程式:
考点:电离方程式的书写
专题:离子反应专题
分析:①一水合氨为弱电解质,在溶液中部分电离出铵根离子和氢氧根离子,存在电离平衡;
②Na2HPO4为强电解质,在溶液中完全电离出磷酸氢根离子和钠离子.
②Na2HPO4为强电解质,在溶液中完全电离出磷酸氢根离子和钠离子.
解答:
解:①一水合氨在溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
②Na2HPO4在溶液中完全电离出磷酸氢根离子和钠离子,其电离方程式为:Na2HPO4=2Na++HPO42-,故答案为:Na2HPO4=2Na++HPO42-.
②Na2HPO4在溶液中完全电离出磷酸氢根离子和钠离子,其电离方程式为:Na2HPO4=2Na++HPO42-,故答案为:Na2HPO4=2Na++HPO42-.
点评:本题考查了电离方程式的书写,题目难度不大,注意掌握强弱电解质的区别,明确强电解质与弱电解质的电离方程式的书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 与溴的四氯化碳溶液反应生成产物的种类 (不考虑立体异构)( )
与溴的四氯化碳溶液反应生成产物的种类 (不考虑立体异构)( )| A、1种 | B、2种 | C、3种 | D、4种 |
配制100mL 1.00mol/L NaCl 溶液,下列说法正确的是( )
| A、将所需量的NaCl溶于100mL水中 |
| B、将所需量的NaCl溶于少量水中,再加水定容到100mL |
| C、将所需量的NaCl直接放入容量瓶中,加水定容到100mL |
| D、定容时俯视读刻度 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1molNa+含有质子数为10NA |
| B、标况下,2.24升CCl4物质的量为0.1mol |
| C、标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、5.6g金属铁与足量盐酸反应时,失去0.3NA个电子 |
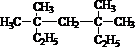 系统命名为
系统命名为