题目内容
将40gNaOH溶于水,配制成250mL溶液A,A的物质的量浓度为 ;取10mLA溶液,加水稀释至100mL后,得到溶液B,溶液B中溶质的物质的量为 .
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算出氢氧化钠的物质的量,再根据c=
计算出该氢氧化钠溶液的物质的量浓度;根据溶液稀释过程中溶质的物质的量不变计算出稀释后溶液的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:40g氢氧化钠的物质的量为:n(NaOH)=
=1mol,
配成的250mL溶于的物质的量浓度为:c(NaOH)=
=4mol/L,
取10mLA溶液,加水稀释至100mL后所带溶液浓度为:c(NaOH)=
=0.4mol/L,
故答案为:4mol/L;0.4mol/L.
| 40g |
| 40g/mol |
配成的250mL溶于的物质的量浓度为:c(NaOH)=
| 1mol |
| 0.25L |
取10mLA溶液,加水稀释至100mL后所带溶液浓度为:c(NaOH)=
| 4mol/L×0.01L |
| 0.1L |
故答案为:4mol/L;0.4mol/L.
点评:本题考查了物质的量浓度的计算,题目难度不大,试题侧重 基础知识的考查,注意掌握物质的量浓度的概念,明确物质的量与摩尔质量、物质的量浓度等物理量之间的关系.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列变化中,需加入还原剂才能实现的是( )
| A、HCl→H2 |
| B、SO2→SO3 |
| C、CO→CO2 |
| D、FeCl2→FeCl3 |
元素周期表中铋元素的数据见右图,下列说法正确的是( )


| A、Bi元素的质量数是209 | ||||
B、H
| ||||
C、
| ||||
| D、原子序数为29的元素位于元素周期表的第四周期ⅠB族 |
将8.4克铁粉和3.2克硫粉混和隔绝空气加热,使之充分反应,再将反应后的物质与足量的稀H2SO4反应,可得到气体体积(标况下)是( )
| A、1.12L | B、2.24L |
| C、3.36L | D、都不对 |
由CO2、N2 和 CO 组成的混合气体在同温、同压下与氧气的密度相同.则该混合气体中CO2、N2 和CO 的体积比为( )
| A、2:1:1 |
| B、2:2:4 |
| C、1:2:2 |
| D、2:3:2 |
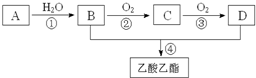 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.