题目内容
有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D都能分别与B按原子个数比为1:1或2:1形成化合物.AC可与EB2反应生成A2B和气态物质EC4.E的M层电子数是K层电子数的2倍.
(1)写出元素下列的名称A: ;B: ;
(2)画出E的原子结构示意图 ,写出电子式D2B2 .
(3)A2B是由 键形成的 分子;EC4是由 键形成的 分子(填“极性”或“非极性”,上同).
(4)比较EB2与EC4的熔点高低 > .
(1)写出元素下列的名称A:
(2)画出E的原子结构示意图
(3)A2B是由
(4)比较EB2与EC4的熔点高低
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D都能分别与B按原子个数比为1:1或2:1形成化合物,则A为氢元素,D为钠元素,B为氧元素,E的M层电子数是K层电子数的2倍,则E为硅元素,AC可与EB2反应生成A2B和气态物质EC4,则C为氟元素,据此答题.
解答:
解:A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D都能分别与B按原子个数比为1:1或2:1形成化合物,则A为氢元素,D为钠元素,B为氧元素,E的M层电子数是K层电子数的2倍,则E为硅元素,AC可与EB2反应生成A2B和气态物质EC4,则C为氟元素,
(1)根据上面的分析可知,A为氢元素,B为氧元素,故答案为:氢;氧;
(2)E为硅元素,其原子结构示意图为 ,D2B2为过氧化钠,它的电子式为
,D2B2为过氧化钠,它的电子式为 ,
,
故答案为: ;
; ;
;
(3)是H2O是由H-O极性共价键构成的极性分子,SiF4是由Si-F极性共价键构成的非极性分子,故答案为:极性;极性;极性;非极性;
(4)SiO2为原子晶体,SiF4为分子晶体,故SiO2沸点高于SiF4,故答案为:SiO2;SiF4.
(1)根据上面的分析可知,A为氢元素,B为氧元素,故答案为:氢;氧;
(2)E为硅元素,其原子结构示意图为
 ,D2B2为过氧化钠,它的电子式为
,D2B2为过氧化钠,它的电子式为 ,
,故答案为:
 ;
; ;
;(3)是H2O是由H-O极性共价键构成的极性分子,SiF4是由Si-F极性共价键构成的非极性分子,故答案为:极性;极性;极性;非极性;
(4)SiO2为原子晶体,SiF4为分子晶体,故SiO2沸点高于SiF4,故答案为:SiO2;SiF4.
点评:本题主要考查的是元素的推断以及元素化合物的知识,元素推断是解题的关键,中等难度,答题时注意化学用语的规范表达.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
下列关于铷的叙述不正确的是( )
| A、金属铷投入水中会引起爆炸 |
| B、铷是一种强还原剂,铷离子很稳定 |
| C、铷受热后,能在空气中剧烈燃烧,生成比过氧化物更复杂的氧化物 |
| D、铷原子的核电荷数比钾原子的核电荷数多,因此铷原子失电子的能力小于钾原子 |
下列有关说法不正确的是( )
| A、C3H8中碳原子都采用的是sp3杂化 |
| B、O2、CO2、N2都是非极性分子 |
| C、酸性:H2CO3<H3PO4<H2SO4<HClO |
D、CO的一种等电子体为NO+,它的电子式为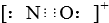 |
现有A、B、C、D四种短周期元素,其中两种是金属元素.已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应.下列说法正确的是( )
| A、A的氢化物比B的氢化物难分解是因为A分子间能形成氢键 |
| B、含C元素的盐溶液一定呈酸性 |
| C、将a g C6H12O6在足量氧气中燃烧产物通入足量A和D按原子个数比1:1组成的化合物中,该化合物增重a g |
| D、D和A两元素形成的化合物,阴阳离子个数比分别为为1:1 和1:2 |
已知M2O7x-+3S 2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
| A、+2价 | B、+3价 |
| C、+4价 | D、+6价 |
下列数量的物质中含原子数最多的是( )
| A、0.4 mol氧气 |
| B、标准状况下5.6 L二氧化碳 |
| C、4°C时5.4 mL水 |
| D、10 g氦气 |