题目内容
根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题.
(1)氧化剂 ,氧化产物 .
(2)用双线桥法标明电子转移的方向和数目
(3)被氧化与被还原的原子数之比为
(4)当生成28gN2时,被氧化的物质的质量是 g.
(5)当反应过程中有3mol电子转移时,参加反应的NH3的物质的量为 mol.
(1)氧化剂
(2)用双线桥法标明电子转移的方向和数目
(3)被氧化与被还原的原子数之比为
(4)当生成28gN2时,被氧化的物质的质量是
(5)当反应过程中有3mol电子转移时,参加反应的NH3的物质的量为
考点:氧化还原反应的电子转移数目计算,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂、Cl2是氧化剂,反应前后元素化合价变化确定电子转移情况;
(2)依据元素化合价变化值=电子转移数,结合化合价的升降确定点的得失;
(3)元素化合价升高的做还原剂,被氧化得到氧化产物;
(4)依据化学方程式结合氨气和电子转移的关系计算得到.
(2)依据元素化合价变化值=电子转移数,结合化合价的升降确定点的得失;
(3)元素化合价升高的做还原剂,被氧化得到氧化产物;
(4)依据化学方程式结合氨气和电子转移的关系计算得到.
解答:
解:(1)反应8NH3+3Cl2=6NH4Cl+N2中氯元素化合价从0价变化为-1价,N元素从-3价升高到0价,氯气做氧化剂,氨气做还原剂,氧化产物为N2;
故答案为:Cl2;N2;
(2)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为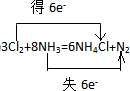 ,故答案为:
,故答案为: ;
;
(3)反应8NH3+3Cl2=6NH4Cl+N2中氯元素化合价从0价变化为-1价,被还原的原子是6个Cl原子,N元素从-3价升高到0价,被氧化的N原子是2个,被氧化与被还原的原子数之比为2:6=1:3,故答案为:1:3;
(4)元素化合价变化分析,2molNH3做还原剂失电子,被氧化,当生成1molN2时,被氧化的氨气物质的量是2mol,所以当生成28g即1molN2时,被氧化的氨气的质量是2mol×17g/mol=34g,故答案为:34;
(5)反应8NH3+3Cl2=6NH4Cl+N2中,有6mol电子转移时,参加反应的NH3的物质的量为8mol,所以有3mol电子转移时,参加反应的NH3的物质的量为4mol,故答案为:4.
故答案为:Cl2;N2;
(2)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为
 ,故答案为:
,故答案为: ;
;(3)反应8NH3+3Cl2=6NH4Cl+N2中氯元素化合价从0价变化为-1价,被还原的原子是6个Cl原子,N元素从-3价升高到0价,被氧化的N原子是2个,被氧化与被还原的原子数之比为2:6=1:3,故答案为:1:3;
(4)元素化合价变化分析,2molNH3做还原剂失电子,被氧化,当生成1molN2时,被氧化的氨气物质的量是2mol,所以当生成28g即1molN2时,被氧化的氨气的质量是2mol×17g/mol=34g,故答案为:34;
(5)反应8NH3+3Cl2=6NH4Cl+N2中,有6mol电子转移时,参加反应的NH3的物质的量为8mol,所以有3mol电子转移时,参加反应的NH3的物质的量为4mol,故答案为:4.
点评:本题考查了氧化还原反应的概念分析判断,氧化还原反应电子转移的计算,准确掌握概念,判断氧化剂还原剂,氧化产物,还原产物,元素化合价变化是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | SO2 | CO2 | 石灰水 |
| ② | HCl | CO2 | 氢氧化钡溶液 |
| ③ | Cl2 | SO2 | BaCl2 |
| ④ | N2 | SO2 | Ba(NO3)2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A、②③④⑤ | B、①③④ |
| C、①②③④⑤ | D、①②③④ |
现有A、B、C、D四种短周期元素,其中两种是金属元素.已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应.下列说法正确的是( )
| A、A的氢化物比B的氢化物难分解是因为A分子间能形成氢键 |
| B、含C元素的盐溶液一定呈酸性 |
| C、将a g C6H12O6在足量氧气中燃烧产物通入足量A和D按原子个数比1:1组成的化合物中,该化合物增重a g |
| D、D和A两元素形成的化合物,阴阳离子个数比分别为为1:1 和1:2 |
将一定体积的密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原H2SO4溶液的浓度为( )
| A、21.9% |
| B、11.0% |
| C、13.5mol/L |
| D、5.67mol/L |
下列数量的物质中含原子数最多的是( )
| A、0.4 mol氧气 |
| B、标准状况下5.6 L二氧化碳 |
| C、4°C时5.4 mL水 |
| D、10 g氦气 |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol Na2O2晶体中共含有4NA个离子 |
| B、0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C、常温常压下16 g O2和O3混合气体含有NA个氧原子 |
| D、1 mol/L的CaCl2溶液中含Cl-的数目为2NA |
下列说法正确的是( )
| A、摩尔是物质的数量单位 |
| B、氢气的摩尔质量是2g |
| C、1molNH3的质量是17g |
| D、1mol气体所占的体积约为22.4L |