题目内容
草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol/L的KMnO4溶液滴定.试回答:
(1)滴定时所发生反应的化学方程式为 .
(2)草酸是二元弱酸,则草酸的电离方程式为 .
(3)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是 mL.图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
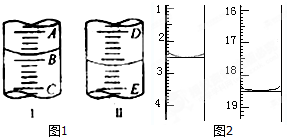
A.是amL B.是(5-a)mLC.一定大于amL D一定大于(25-a)mL
(4)实验中,标准液KMnO4溶液应装在 式滴定管中.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会 (填“偏大”、“偏小”或“无影响”)达到滴定终点,溶液由 色变为 色.
(5)在滴定过程中若用去a mol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L.
(6)若滴定终点读数时俯视,则计算的x值会 (填“偏大”、“偏小”或“无影响”).
(7)若测得x=2,称取某二水合草酸晶体0.1200g,加适量水完全溶解,然后用0.02000mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为 .
称取Wg草酸晶体,配成100.00mL无色水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol/L的KMnO4溶液滴定.试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为
(3)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是

A.是amL B.是(5-a)mLC.一定大于amL D一定大于(25-a)mL
(4)实验中,标准液KMnO4溶液应装在
(5)在滴定过程中若用去a mol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
(6)若滴定终点读数时俯视,则计算的x值会
(7)若测得x=2,称取某二水合草酸晶体0.1200g,加适量水完全溶解,然后用0.02000mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为
考点:中和滴定
专题:
分析:(1)根据题目中给出的条件,可以判断硫酸是反应物,KMnO4溶液具有氧化性,能将草酸氧化生成二氧化碳,本身钡还原成硫酸锰,再根据化合价升降总数相等以及质量守恒来配平;
(2)根据多元弱酸分步电离;
(3)根据量筒的结构和精确度来解答;根据滴定管的结构来解答;
(4)KMnO4溶液具有强氧化性,可以腐蚀橡皮管;根据c(待测)═
分析误差;
根据KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
(5)根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出H2C2O4的物质的量浓度;
(6)若滴定终点读数时俯视,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大.
(7)先根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出H2C2O4的物质的量,然后求出质量并算出样品中草酸晶体的纯度.
(2)根据多元弱酸分步电离;
(3)根据量筒的结构和精确度来解答;根据滴定管的结构来解答;
(4)KMnO4溶液具有强氧化性,可以腐蚀橡皮管;根据c(待测)═
| c(标准)×V(标准) |
| V(待测) |
根据KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
(5)根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出H2C2O4的物质的量浓度;
(6)若滴定终点读数时俯视,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大.
(7)先根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出H2C2O4的物质的量,然后求出质量并算出样品中草酸晶体的纯度.
解答:
解:(1)硫酸是反应物,KMnO4溶液具有氧化性,能将草酸氧化生成二氧化碳,本身钡还原成硫酸锰,再根据化合价升降总数相等以及质量守恒来配平得:2KMnO4 +5H2C2O4+3H2SO4=K2SO4 +10CO2↑+2MnSO4 +8H2O,
故答案为:2KMnO4 +5H2C2O4+3H2SO4=K2SO4 +10CO2↑+2MnSO4 +8H2O;
(2)草酸是二元弱酸,则草酸的电离方程式为H2C2O4?H++HC2O4-,HC2O4-?C2O42-+H+;
故答案为:H2C2O4?H++HC2O4-,HC2O4-?C2O42-+H+;
(3)量筒中液体的体积是22.0mL,由于滴定管下端有一段没有刻度,滴定管中液体的体积一定大于(25-a)mL;
故答案为:22.0;D;
(4)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的量,对V(标准)无影响,根据c(待测)═
分析,c(待测)不变,所测得的x值无影响;
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
故答案为:酸;无影响;无;紫红;
(5)2KMnO4 +5H2C2O4 +3H2SO4 =K2SO4+10CO2↑+2MnSO4+8H2O
2 5
amol?L-1×VmL C(H2C2O4)×25.00mL
C(H2C2O4)=
mol?L-1;
故答案为:
;
(6)若滴定终点读数时俯视,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大;
故答案为:偏大;
(7)消耗的高锰酸钾n(KMnO4)=0.016L×0.0200mol?L-1=3.2×10-3mol,
2KMnO4 +3H2SO4 +5H2C2O4 =K2SO4+10CO2↑+2MnSO4+8H2O
2 5
3.2×10-3mol 8×10-3mol
样品中二水合草酸的质量为m=8×10-3mol×126g/mol=8×126×10-3g=1.008g,
则该草酸晶体样品中二水合草酸的质量分数为
×100%=84.00%,
故答案为:84.00%.
故答案为:2KMnO4 +5H2C2O4+3H2SO4=K2SO4 +10CO2↑+2MnSO4 +8H2O;
(2)草酸是二元弱酸,则草酸的电离方程式为H2C2O4?H++HC2O4-,HC2O4-?C2O42-+H+;
故答案为:H2C2O4?H++HC2O4-,HC2O4-?C2O42-+H+;
(3)量筒中液体的体积是22.0mL,由于滴定管下端有一段没有刻度,滴定管中液体的体积一定大于(25-a)mL;
故答案为:22.0;D;
(4)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的量,对V(标准)无影响,根据c(待测)═
| c(标准)×V(标准) |
| V(待测) |
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
故答案为:酸;无影响;无;紫红;
(5)2KMnO4 +5H2C2O4 +3H2SO4 =K2SO4+10CO2↑+2MnSO4+8H2O
2 5
amol?L-1×VmL C(H2C2O4)×25.00mL
C(H2C2O4)=
| aV |
| 10 |
故答案为:
| aV |
| 10 |
(6)若滴定终点读数时俯视,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大;
故答案为:偏大;
(7)消耗的高锰酸钾n(KMnO4)=0.016L×0.0200mol?L-1=3.2×10-3mol,
2KMnO4 +3H2SO4 +5H2C2O4 =K2SO4+10CO2↑+2MnSO4+8H2O
2 5
3.2×10-3mol 8×10-3mol
样品中二水合草酸的质量为m=8×10-3mol×126g/mol=8×126×10-3g=1.008g,
则该草酸晶体样品中二水合草酸的质量分数为
| 1.008g |
| 1.2g |
故答案为:84.00%.
点评:解答本题要从实验的目的出发,抓住定量关系,问题都会迎刃而解.虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似.

练习册系列答案
相关题目
准确量取25.00mL KMnO4溶液于锥形瓶中并用某无色未知浓度的还原性A溶液进行滴定,所选仪器和指示剂均正确的是( )
| A、50 mL酸式滴定管;甲基橙 |
| B、50 mL碱式滴定管;酚酞 |
| C、50 mL量筒;石蕊 |
| D、50 mL酸式滴定管;不用指示剂 |
 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为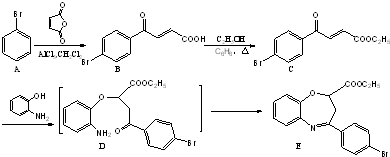
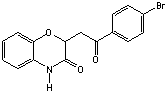 和一种常见的有机物F,F的结构简式为
和一种常见的有机物F,F的结构简式为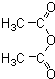
 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.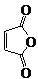 为原料制备化合物
为原料制备化合物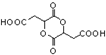 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例: