题目内容
4.铁单质及其化合物在生活生产中应用广泛.(l)硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)Fe3++3H2O?Fe(OH)3(胶体)+3H+.
(2)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K2.79×103
(3)电浮选凝聚法是工业上采用的一种污水处理方法,保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到浮选净化的作用.某研究小组设计装置如图所示.
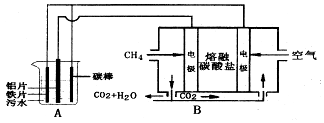
①装置B中通入空气的电极反应是O2+2CO2+4e-=2CO32-
②装置A中,阳极的电极反应式分别为 Fe-2e-=Fe2+、4OH--4e-=2H2O+O2↑
③实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的c
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(4)工业催化剂K3[Fe(C2O4)3]•3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O.实验室由草酸亚铁晶体(FeC2O4•2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备.
①制备过程要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学方程式H2C2O4+H2O2=2CO2↑+2H2O.
②配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3?[Cu(NH3)4]2+,其稳定常数表达式为:K=$\frac{c[Cu(N{H}_{3}{)_{4}}^{2+}]}{c(C{u}^{2+}){c}^{4}(N{H}_{3})}$.已知:[Fe(C2O4)3]3-的稳定常数Kl=1020,Fe(SCN)3的稳定常数K2=2×103,请设计检验K3[Fe(C2O4)3]•3H2O中铁元素的方案取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无.
分析 (l)三价铁水解生成的氢氧化铁胶体具有净水作用;
(2)根据反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{{K}_{sp}(Fe(OH)_{3})}{{K}_{w}}$计算;
(3)B能自发的进行氧化还原反应,为原电池,通入甲烷的电极为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入空气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-;A有外接电源,属于电解池,电解池中Fe和碳棒为阳极,发生Fe-2e-=Fe2+,Al为阴极,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,据此分析解答.
①通入空气的一极为正极,发生还原反应;
②A有外接电源,属于电解池,根据阳极电极材料和离子的放电顺序考虑放电的离子,并书写电极反应式;
③能使导电能力增强的电解质必须是易溶于水的,且只能是中性的;
(4)①草酸被H2O2氧化生成水和二氧化碳;
②K3[Fe(C2O4)3]•3H2O中的铁为亚铁离子,而铁离子遇KSCN溶液变为血红色.
解答 解:(1)氯化铁为强酸弱碱盐,在水中发生水解,三价铁水解生成的氢氧化铁胶体具有净水作用,原理方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{{K}_{sp}(Fe(OH)_{3})}{{K}_{w}}$=$\frac{2.79×1{0}^{-39}}{(1×1{0}^{-14})^{3}}$=2.79×103,
故答案为:2.79×103;
(3)①通入空气的一极为正极,发生还原反应,B中电解质为熔融碳酸盐,所以正极反应式为O2+2CO2+4e-=2CO32-,
故答案为:O2+2CO2+4e-=2CO32-;
②电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
③保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,所以c符合,
故答案为:c;
(4)①草酸被H2O2氧化生成水和二氧化碳,该反应为H2C2O4+H2O2=2CO2↑+2H2O,
故答案为:H2C2O4+H2O2=2CO2↑+2H2O;
②K3[Fe(C2O4)3]•3H2O中的铁为亚铁离子,则不能用KSCN溶液检验K3[Fe(C2O4)3]•3H2O中的铁元素,检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无,
故答案为:取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无.
点评 本题考查知识点较多,涉及盐类水解、沉淀溶解平衡、原电池和电解池原理、离子检验等知识,为高频考点,侧重考查学生分析计算能力,明确原电池和电解池区别、各个电极上发生的反应、转移电子守恒是解本题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 用石墨电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |

| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
| A. | 漂白粉、漂粉精可用于饮用水及餐具等的消毒 | |
| B. | 福尔马林可用于食品的消毒,如浸泡海鲜,使其不易变质 | |
| C. | 药用酒精可用于食物及饮用水消毒 | |
| D. | 过氧乙酸无须稀释可直接使用消毒,不会对人体造成伤害 |
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| A. | 用该溶液滴定未知浓度的NaOH溶液,用甲堪橙作指示剂 | |
| B. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}_{3}B{O}_{3})}$减小 | |
| C. | 常温下,加入等体积pH=9的NaOH溶液后,溶液呈中性 | |
| D. | 常温下,向该溶液滴加NaOH溶液至pH=7时,c(Na+)=c([B(OH)4]-)>c(H+)=c(OH-) |

 和
和