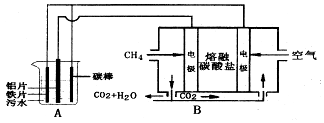
题目内容
14.下列离子方程式中正确的是( )| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 用石墨电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
分析 A.铜与稀硝酸反应生成的是NO气体;
B.用石墨电极电解饱和食盐水生成氢氧化钠、氢气和氯气;
C.氢氧化钠过量,铵根离子也参与反应;
D.HI过量,硝酸根离子和铁离子都完全反应.
解答 解:A.Cu溶于稀HNO3生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故A错误;
B.用石墨电极电解饱和食盐水,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故B正确;
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2,铵根离子也参与反应,正确的离子方程式为:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故C错误;
D.硝酸铁稀溶液中加入足量稀氢碘酸,氢碘酸足量,铁离子和硝酸根离子都完全反应,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
9.下列各组离子能在溶液中大量共存的是( )
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Na+、HCO3-、OH-、Ca2+ | D. | Cu2+、K+、SO42-、NO3- |
9.下列实验操作中错误的是( )
| A. | 蒸发操作时,应等加热至蒸发皿中剩余较少液体时,立即停止加热 | |
| B. | 蒸馏操作时,应使温度计液泡靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
19.化学与生活息息相关,下列说法不正确的是( )
| A. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| B. | 汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 服用阿司匹林出现水杨酸反应时,可以用NaHCO3溶液解毒 | |
| D. | 水玻璃可用作黏合剂和防火剂 |
3.某化学小组同学用下列装置(气密性已检验)进行实验.
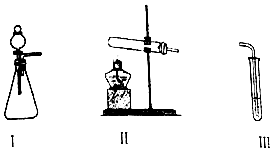
探究O2与KI溶液发生反应的条件.
①甲、乙同学选用以下试剂进行实验(0.1mol•L-1KI溶液,30%H2O2溶液、0.1mol•L-1H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如表.
甲制取O2的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
乙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
②甲用II加入试剂替换I后,III中仍加入KI、淀粉溶液,再次实验时III中溶液不变蓝.由此他猜测第一次实验时可能是I中的白雾使溶液变蓝.甲又将I中产生的气体直接通入下列a溶液(填序号),证明了白雾中含有H2O2.
a.酸性KMnO4 b.FeCl2 c.Na2S
③由甲、乙两同学的实验,可得出结论:KI溶液在酸性条件下易被O2氧化.

探究O2与KI溶液发生反应的条件.
①甲、乙同学选用以下试剂进行实验(0.1mol•L-1KI溶液,30%H2O2溶液、0.1mol•L-1H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如表.
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
乙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
②甲用II加入试剂替换I后,III中仍加入KI、淀粉溶液,再次实验时III中溶液不变蓝.由此他猜测第一次实验时可能是I中的白雾使溶液变蓝.甲又将I中产生的气体直接通入下列a溶液(填序号),证明了白雾中含有H2O2.
a.酸性KMnO4 b.FeCl2 c.Na2S
③由甲、乙两同学的实验,可得出结论:KI溶液在酸性条件下易被O2氧化.
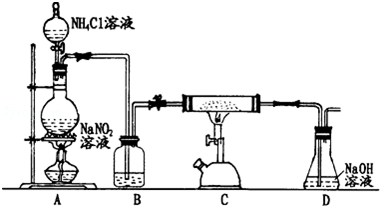
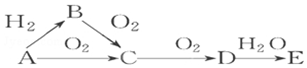 已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.
已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.