题目内容
短周期元素W、X、Y、Z的原子序数依次增大,W与Y,X与Z分别位于同一主族,W与X可形成两种常见气体WX2和WX,Y原子的内层电子总数是其最外层电子数的2.5倍,下列叙述中不正确的是( )
| A、WX2分子中所有原子最外层都已满足8电子结构 |
| B、WX2、ZX2的化学键类型相同 |
| C、原子半径大小顺序为:X<W<Y<Z |
| D、乙醇、乙酸、葡萄糖、油脂中均含W、X两种元素 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素中,Y原子的内层电子总数是其最外层电子数的2.5倍,只能有3个电子层,最外层电子数为4,则Y为Si元素,W与Y位于同一主族,则W为C元素,W与X可形成两种常见气体WX2和WX,则X为O元素,X与Z位于同一主族,则Z为S元素,据此解答.
解答:
解:短周期元素中,Y原子的内层电子总数是其最外层电子数的2.5倍,只能有3个电子层,最外层电子数为4,则Y为Si元素,W与Y位于同一主族,则W为C元素,W与X可形成两种常见气体WX2和WX,则X为O元素,X与Z位于同一主族,则Z为S元素,
A.W与X可形成共价化合物CO2,分子中各原子均达到8e-稳定结构,故A正确;
B.CO2和SO2的均含极性键,分别为C=O和S=O键,故B正确;
C.同周期自左而右原子半径逐渐减小,电子层越多原子半径越大,故原子半径:O<C<S<Si,故C错误;
D.乙醇、乙酸、葡萄糖、油脂中均含C、H、O元素,故D正确,
故选:C.
A.W与X可形成共价化合物CO2,分子中各原子均达到8e-稳定结构,故A正确;
B.CO2和SO2的均含极性键,分别为C=O和S=O键,故B正确;
C.同周期自左而右原子半径逐渐减小,电子层越多原子半径越大,故原子半径:O<C<S<Si,故C错误;
D.乙醇、乙酸、葡萄糖、油脂中均含C、H、O元素,故D正确,
故选:C.
点评:本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,难度不大,关键是根据原子结构特点正确推断元素.

练习册系列答案
相关题目
将铁屑溶于过量盐酸后,滴加KSCN溶液后再加入下列物质,溶液会变为红色的是( )
| A、硫酸 | B、氨水 |
| C、硝酸锌 | D、氯化铜 |
在标准状况下,一个盛满空气的容器重95.3g(已知空气的平均相对分子质量为29.0),在相同条件下若改盛满SO2气体时重98.8g,则此容器的体积约是( )
| A、0.560L |
| B、1.12L |
| C、2.24L |
| D、3.36L |
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
X元素的气态单质X2 10mL与Y元素的气态单质Y2 20mL均完全反应后生成气态物Z 20mL(气体体积均在相同条件下测得).气态物Z的分子式为( )
| A、XY |
| B、X2Y |
| C、XY2 |
| D、XY3 |
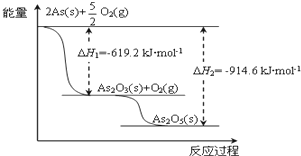 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题: