题目内容
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol?L-1Na2A溶液pH=6,则下列说法正确的是( )
| A、H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?H++A2- |
| B、(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-) |
| C、0.0lmol?L-l的H2A溶液pH=2 |
| D、等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多 |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题
分析:95℃时,KW=1.0×10-12,则该温度下水中c(H+)=
=1.0×10-6mol/L,pH=6,在该温度下,测得0.1mol?L-1Na2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,据此分析解答.
| Kw |
解答:
解:95℃时,KW=1.0×10-12,则该温度下水中c(H+)=
=1.0×10-6mol/L,pH=6,在该温度下,测得0.1mol?L-1Na2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,
A.通过以上分析知H2A是强酸,其电离方程式为H2A=2H++A2-,故A错误;
B.(NH4)2A为强酸弱碱盐,铵根离子水解导致溶液呈酸性,铵根离子水解程度较小,所以溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-),故B正确;
C.0.0lmol?L-l的H2A溶液中c(H+)=0.02mol/L,所以pH<2,故C错误;
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,不能确定锌是否完全反应,所以无法判断哪种酸产生氢气多,故D错误;
故选B.
| Kw |
A.通过以上分析知H2A是强酸,其电离方程式为H2A=2H++A2-,故A错误;
B.(NH4)2A为强酸弱碱盐,铵根离子水解导致溶液呈酸性,铵根离子水解程度较小,所以溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-),故B正确;
C.0.0lmol?L-l的H2A溶液中c(H+)=0.02mol/L,所以pH<2,故C错误;
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,不能确定锌是否完全反应,所以无法判断哪种酸产生氢气多,故D错误;
故选B.
点评:本题考查弱电解质电离,正确判断酸的强弱是解本题关键,再结合物质之间的反应分析解答,同时考查学生灵活运用知识解答问题能力,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下列物质的分子中,只含有极性共价键的是( )
| A、氯化镁 | B、单质碘 | C、乙烷 | D、水 |
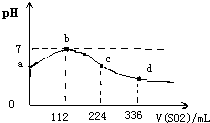 标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A、原H2S溶液的物质的量浓度为0.05mol/L |
| B、氢硫酸的酸性比亚硫酸的酸性强 |
| C、b点水的电离程度比c点水的电离程度大 |
| D、a点对应溶液的导电性比d点强 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1L 0.1 mol?L-1的H2SO4溶液中粒子数为0.15NA |
| B、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| C、1mol CO2分子中共用电子对数为2NA |
| D、23g Na与足量的O2完全反应,失去的电子数目为NA |
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
某合金(仅含铜、铁)将其全部投入50mL 某浓度的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中一定含有Fe3+ |
| C、溶液中可能只有Cu2+ |
| D、溶液中可能只有Fe2+ 和Cu2+ |