题目内容
14.己知下列反应的能量变化示意图如下,下列有关说法正确的是( )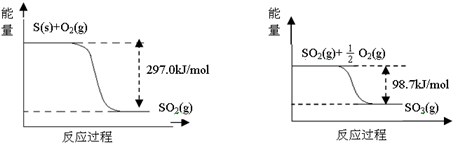
| A. | 1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ | |
| B. | 在相同条件下,SO3(g)比SO2(g)稳定 | |
| C. | 1molSO2(g)和$\frac{1}{2}$molO2(g)生成1molSO3(g)放出98.7kJ的热量 | |
| D. | 由图得S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-198.3kJ/mol |
分析 A、相同量的 S(g)的能量大于S(s)的能量;
B、能量越高越不稳定;
C、二氧化硫和氧气的反应为可逆反应不能进行彻底;
D、结合图象和盖斯定律分析计算,已知 S(s)+O2(g)=SO2(g)△H=-297.07kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-98.7kJ/mol,把两个方程相加得到热化学方程式分析判断.
解答 解:A、相同量的 S(g)的能量大于S(s)的能量,所以1mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量>297.0kJ/mol,故A错误;
B、能量越高越不稳定,由图象可知SO2(g)的能量大于SO3(g),所以SO3(g)比SO2(g)稳定,故B正确;
C、反应为可逆反应,所以1mol SO2(g)和$\frac{1}{2}$mol O2(g)生成1mol SO3(g)放出热量小于98.7kJ/mol,故C错误;
D、已知 S(s)+O2(g)=SO2(g)△H=-297.07kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-98.7kJ/mol,把两个方程相加得到 S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-395.7kJ/mol,故D错误;
故选B.
点评 本题考查了化学反应能量变化的分析判断,图象分析是解题关键,题目较简单,注意盖斯定律的计算应用.

练习册系列答案
相关题目
5.在能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是( )
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
| A. | ②⑤ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
2.下列化学用语正确的是( )
①羟基的电子式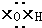 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2
③甲烷的结构式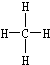 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4
⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
①羟基的电子式
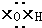 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2③甲烷的结构式
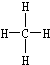 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
| A. | ①④ | B. | ②④⑥ | C. | ②③ | D. | ②③⑤ |
9.下列叙述正确的是( )
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 | |
| C. | 醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b<a+1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na+)最小的是Na2CO3 |
6.下列反应属于吸热反应的是( )
| A. | 稀硫酸与氢氧化钾溶液反应 | B. | 食物腐败 | ||
| C. | 锌与稀硫酸的反应 | D. | 氢氧化钡晶体与氯化铵晶体反应 |
3.某元素X的核外电子数等于核内中子数,取该元素单质2.8克与氧充分作用,可得到6克化合物XO2.下列说法正确的是( )
| A. | 该元素位于第2周期 | |
| B. | 该元素位于第VI A族 | |
| C. | 该元素的氢化物溶于水显碱性 | |
| D. | 该元素最高价氧化物的水化物是一种弱酸 |
4.室温时,下列溶液等体积混合后pH一定小于7的是( )
| A. | pH=3的盐酸和pH=11的氨水 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液 | |
| C. | pH=3的硫酸和pH=11的氨水 | |
| D. | pH=3的醋酸和pH=11的氢氧化钡溶液 |