题目内容
13.某有机物结构简式为: ,它不可能发生的反应类型( )
,它不可能发生的反应类型( )| A. | 取代 | B. | 氧化 | C. | 水解 | D. | 酯化 |
分析 该有机物中含酚-OH、醇-OH、-COOH,结合酚、醇、羧酸的性质来解答.
解答 解:有机物含有羟基、羧基,可发生取代反应、酯化反应,羟基可发生氧化反应,不能发生水解反应.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,注意把握有机物中的官能团与性质的关系,熟悉常见有机物的性质即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
18.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L SO3含有NA个分子 | |
| B. | 过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2 NA | |
| C. | 6.4 g氧气和3.2 g臭氧(O3)混合气体所含有的氧原子数为0.6 NA | |
| D. | 标准状况下,2.24 L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1 NA |
5.在能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是( )
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
| A. | ②⑤ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
2.下列化学用语正确的是( )
①羟基的电子式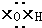 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2
③甲烷的结构式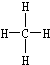 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4
⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
①羟基的电子式
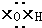 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2③甲烷的结构式
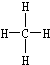 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
| A. | ①④ | B. | ②④⑥ | C. | ②③ | D. | ②③⑤ |
3.某元素X的核外电子数等于核内中子数,取该元素单质2.8克与氧充分作用,可得到6克化合物XO2.下列说法正确的是( )
| A. | 该元素位于第2周期 | |
| B. | 该元素位于第VI A族 | |
| C. | 该元素的氢化物溶于水显碱性 | |
| D. | 该元素最高价氧化物的水化物是一种弱酸 |
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
 ;
; ;
; ;
; (写出一种即可).
(写出一种即可).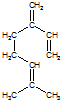 ,也可简写为
,也可简写为 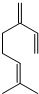 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).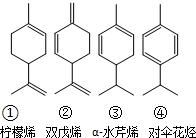
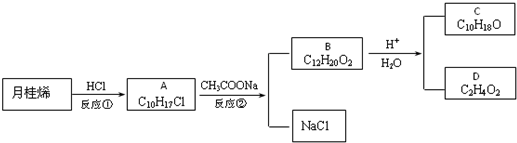
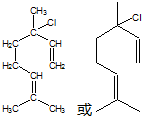 .
. .
.