题目内容
2.0.5mol K2SO4、1mol Al2(SO4)3和1.5molKAl(SO4)2•12H2O的混合物溶于足量水中,所得溶液中n(K+):n(Al3+):n(SO${\;}_{4}^{2-}$)=5:7:12;由AlCl3和Al2(SO4)3共同配成的溶液中n(Al3+)=n(Cl-),n(Al3+):n(SO${\;}_{4}^{2-}$)=1:1.分析 0.5mol K2SO4、1mol Al2(SO4)3和1.5molKAl(SO4)2•12H2O的混合物溶于足量水中,所得溶液中n(K+)=0.5×2+1.5=2.5mol,n(Al3+)=2+1.5=3.5mol,n(SO42-)=3+3=6mol,所以n(K+):n(Al3+):n(SO42-)=2.5mol:3.5mol:6mol=5:7:12,设AlCl3和Al2(SO4)3的物质的量为:xmol和ymol,n(Al3+)=x+2y;n(Cl-)=3x,所以x+2y=3x,则x=y,由此分析解答.
解答 解:0.5mol K2SO4、1mol Al2(SO4)3和1.5molKAl(SO4)2•12H2O的混合物溶于足量水中,所得溶液中n(K+)=0.5×2+1.5=2.5mol,n(Al3+)=2+1.5=3.5mol,n(SO42-)=3+3=6mol,所以n(K+):n(Al3+):n(SO42-)=2.5mol:3.5mol:6mol=5:7:12,设AlCl3和Al2(SO4)3的物质的量为:xmol和ymol,n(Al3+)=x+2y;n(Cl-)=3x,所以x+2y=3x,则x=y,所以n(Al3+):n(SO42-)=3y:3y=1:1,故答案为:5:7:12;1:1.
点评 本题考查学生物质的量的应用以及物质的微粒构成之间的关系,难度不大.

练习册系列答案
相关题目
17.关于苯分子的说法正确的是( )
| A. | 分子中共含有6个极性键 | B. | 分子中不含非极性键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有π键 |
5.在能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是( )
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
| A. | ②⑤ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
6.下列反应属于吸热反应的是( )
| A. | 稀硫酸与氢氧化钾溶液反应 | B. | 食物腐败 | ||
| C. | 锌与稀硫酸的反应 | D. | 氢氧化钡晶体与氯化铵晶体反应 |
 Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.
Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.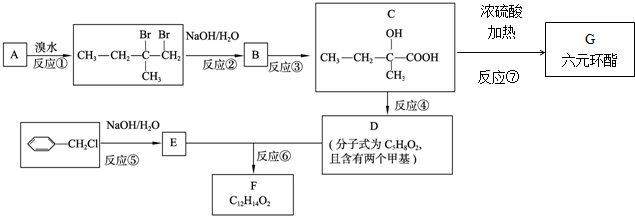
 .
.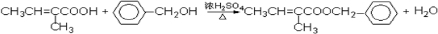 .
. 、
、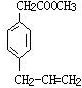 、
、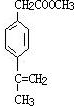 .
. ,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质.请回答下列问题:
 ;
; ;
; ;
; (写出一种即可).
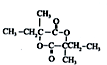
(写出一种即可).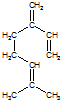 ,也可简写为
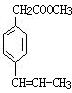
,也可简写为 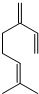 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).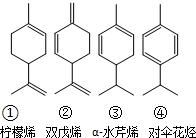
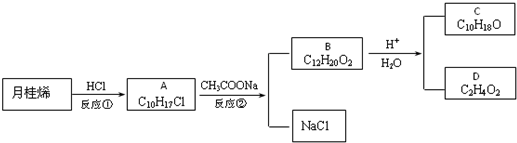
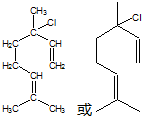 .
. .
.