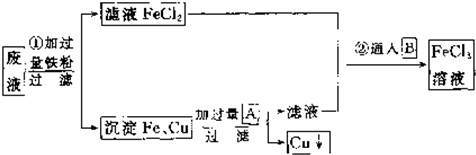
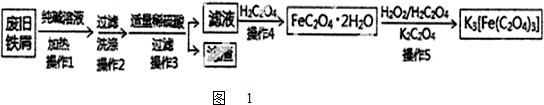
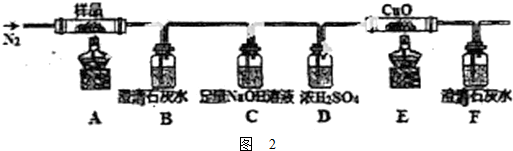
题目内容
一定温度下,满足下列条件的溶液一定呈酸性的是( )
| A、c(H+)>c(OH-)的任意水溶液 |
| B、加酚酞后显无色的溶液 |
| C、pH=6的某溶液 |
| D、能与金属Al反应放出H2的溶液 |
考点:探究溶液的酸碱性,水的电离
专题:电离平衡与溶液的pH专题
分析:一定温度下,只要溶液中存在c(H+)>c(OH-)该溶液呈酸性,c(H+)=c(OH-)的溶液呈中性,c(H+)<c(OH-)的溶液呈碱性,不能根据溶液的pH大小判断溶液酸碱性.
解答:
解:A.c(H+)>c(OH-)的任意水溶液都呈酸性,故A正确;
B.酚酞试液的变色范围是8-10,所以加酚酞后显无色的溶液可能呈中性或碱性或酸性,故B错误;
C.100℃的水中pH=6,水溶液呈中性,故C错误;
D.能与金属Al反应放出H2的溶液可能呈酸性或碱性,所以该反应不一定呈酸性,故D错误;
故选A.
B.酚酞试液的变色范围是8-10,所以加酚酞后显无色的溶液可能呈中性或碱性或酸性,故B错误;
C.100℃的水中pH=6,水溶液呈中性,故C错误;
D.能与金属Al反应放出H2的溶液可能呈酸性或碱性,所以该反应不一定呈酸性,故D错误;
故选A.
点评:本题考查溶液酸碱性判断,只有根据溶液中氢离子和氢氧根离子浓度相对大小判断溶液酸碱性,不能根据溶液的pH判断,为易错题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.04g铜镁合金完全溶解于100mL密度为1.40g?mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.00mol?L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀.下列说法不正确的是( )
| A、得到5.08g沉淀时,加入NaOH溶液的体积是600mL |
| B、该合金中铜与镁的物质的量之比是2:l |
| C、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| D、NO2和N2O4的混合气体中,NO2的体积分数是80% |
下列有关实验事实及其解释正确的是( )
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含Fe2+ |
| B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
下列物质的分离方法不正确的是( )
| A、用过滤的方法除去食盐中泥沙 |
| B、用蒸馏的方法将海水淡化 |
| C、用酒精萃取碘水中的碘单质 |
| D、用加热的方法除去碳酸钠中的碳酸氢钠 |
 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇 燃料电池的总反应式2CH40+302=2C02↑+4H20,如图是该燃料电池的示意图.下列说法错误的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇 燃料电池的总反应式2CH40+302=2C02↑+4H20,如图是该燃料电池的示意图.下列说法错误的是( )| A、燃料电池将化学能转化为电能 |
| B、a是甲醇,b是氧气 |
| C、质子从M电极区穿过交换膜移向N电极区 |
| D、负极反应:CH40-6e-+H20=C02↑+6H+ |
下列叙述中,正确的是( )
| A、溶度积大的化合物溶解度肯定大 |
| B、向含有AgCl固体的溶液中加入适量的水使溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| C、将难溶电解质放入水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D、AgCl水溶液的导电性很弱,所以AgCl为弱电解质 |
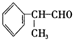 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: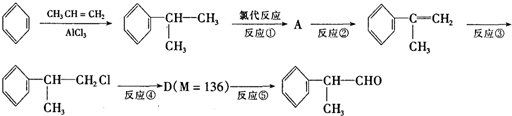
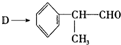 反应的化学方程式为
反应的化学方程式为