题目内容
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.以废旧铁屑(含少量CuO、Fe2O3等杂质)为原料的制备流程如图1: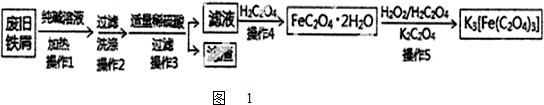
(1)操作3发生的氧化还原反应至少有 个.操作5中试剂H2O2的作用是 ?
(2)滤液中主要含FeSO4,需加入少量的H2SO4酸化,目的是 .若要使含FeSO4溶液中得到绿矾晶体(FeSO4?7H2O).必须进行的实验操作是 (按顺序填写).
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应.
①分解得到的气体产物用如图2装置进行实验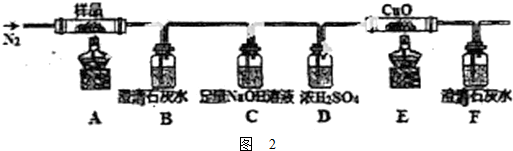
装置检查气密性后,先通一段时间N2,其目的为 .结束实验时先熄灭酒精灯再通入N2至常温,其目的为 .实验过程中观察到B、F中澄清石灰水都变浑浊.E中有红色固体生成,则气体产物是 .
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品.学生甲、乙、丙分别设计了下列三种实验方案对该样品进行物质含量测定.
【甲】ag样品
溶液
得固体bg
【乙】ag样品
量气测得气体体积VamL
【丙】ag样品
250mL溶液
三次平均消耗0.10mol/L酸性KMnO4
你认为以上方案中, 方案无法确定样品的组成,理由是 .

(1)操作3发生的氧化还原反应至少有
(2)滤液中主要含FeSO4,需加入少量的H2SO4酸化,目的是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应.
①分解得到的气体产物用如图2装置进行实验

装置检查气密性后,先通一段时间N2,其目的为
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品.学生甲、乙、丙分别设计了下列三种实验方案对该样品进行物质含量测定.
【甲】ag样品
| 足量稀硝酸 |
| 搅拌 |
| 足量NaOH |
| 搅拌 |
| 过滤洗涤 |
| 烘干灼烧 |
【乙】ag样品
| 足量稀硫酸 |
| 搅拌 |
| 测量气体体积 |
【丙】ag样品
| 足量稀盐酸 |
| 溶解配制 |
| 每次取25mL溶液 |
| 用酸性KMnO4溶液滴定 |
你认为以上方案中,
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)铁屑、CuO、Fe2O3等可以和硫酸反应得到硫酸亚铁、硫酸铁以及硫酸铜的混合溶液,双氧水具有氧化性,能将亚铁离子氧化;
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,根据硫酸亚铁溶液得到绿矾晶体的操作来回答;
(3)①根据实验原理生成的金属铜能被氧气氧化,应将装置中的空气排净,注意装置的倒吸现象;
②高锰酸钾具有氧化性,能将氯离子氧化,这样会干扰实验结果,对比三项试验方案得到结论.
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,根据硫酸亚铁溶液得到绿矾晶体的操作来回答;
(3)①根据实验原理生成的金属铜能被氧气氧化,应将装置中的空气排净,注意装置的倒吸现象;
②高锰酸钾具有氧化性,能将氯离子氧化,这样会干扰实验结果,对比三项试验方案得到结论.
解答:
解:铁屑、CuO、Fe2O3等可以和硫酸反应得到硫酸亚铁、硫酸铁以及硫酸铜的混合溶液,向其中加入草酸,可以得到草酸亚铁晶体,再加入双氧水,可以将草酸亚铁氧化为草酸铁,在草酸以及草酸钾的作用下得到三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O.
(1)铁屑、CuO、Fe2O3都可以和硫酸反应得到硫酸亚铁、硫酸铁以及硫酸铜的混合溶液,操作3发生的氧化还原反应:金属铁和硫酸的反应,金属铁和硫酸铜之间的反应,金属铁和硫酸铁之间的反应,即至少有3个,双氧水具有氧化性,能将亚铁离子氧化,操作5中试剂H2O2的作用是将亚铁离子氧化为铁离子,
故答案为:3;将亚铁离子氧化为铁离子;
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,硫酸亚铁溶液得到绿矾晶体的操作蒸发浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:防止亚铁离子水解;bcae;
(3)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体一氧化碳的产生,
故答案为:排除装置中的空气,防止干扰实验结果;防止倒吸;CO2、CO;
②在实验方案丙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成,故答案为:方案丙;使用盐酸溶解样品,氯离子也可以被高锰酸根离子氧化.
(1)铁屑、CuO、Fe2O3都可以和硫酸反应得到硫酸亚铁、硫酸铁以及硫酸铜的混合溶液,操作3发生的氧化还原反应:金属铁和硫酸的反应,金属铁和硫酸铜之间的反应,金属铁和硫酸铁之间的反应,即至少有3个,双氧水具有氧化性,能将亚铁离子氧化,操作5中试剂H2O2的作用是将亚铁离子氧化为铁离子,
故答案为:3;将亚铁离子氧化为铁离子;
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,硫酸亚铁溶液得到绿矾晶体的操作蒸发浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:防止亚铁离子水解;bcae;
(3)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体一氧化碳的产生,
故答案为:排除装置中的空气,防止干扰实验结果;防止倒吸;CO2、CO;
②在实验方案丙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成,故答案为:方案丙;使用盐酸溶解样品,氯离子也可以被高锰酸根离子氧化.
点评:本题是一道物质的分离和提纯的实验操作以及计算知识的综合考查题,涉及的知识较多,综合性强,难度大.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
在密闭容器中充入CO2、CO、H2、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加m g;则CO2:CO:H2:CH4的体积比为( )
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
一定温度下,满足下列条件的溶液一定呈酸性的是( )
| A、c(H+)>c(OH-)的任意水溶液 |
| B、加酚酞后显无色的溶液 |
| C、pH=6的某溶液 |
| D、能与金属Al反应放出H2的溶液 |
升高温度,下列数据不一定增大的是( )
| A、电离平衡常数Ka |
| B、水解平衡常数Kb |
| C、化学平衡常数K |
| D、水的离子积常数Kw |

 制成,合成路线如下:
制成,合成路线如下:

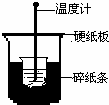 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.