题目内容
3.糖类、油脂、蛋白质都是人体必需的营养物质.请回答:(1)向蛋白质溶液中加入饱和(NH4)2SO4溶液可使蛋白质盐析(填“盐析”或“变性”).
(2)油脂被摄入人体后,在酶的作用下水解生成高级脂肪酸和甘油(写名称).
(3)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基和羧基(写名称).氨基酸能(填“能”或“不能”)与盐酸反应.
(4)葡萄糖是一种重要的单(填“单”“二”或“多”)糖,部分葡萄糖在体内被氧化生成二氧化碳和水,同时放出(填“放出”或“吸收”)能量.写出葡萄糖在体内被氧化的化学方程式:C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O.
分析 (1)重金属盐可使蛋白质变性,而铵盐、钠盐、钾盐等可使蛋白质盐析;
(2)油脂可水解生成高级脂肪酸和甘油;
(3)氨基酸含有氨基和羧基,具有两性;
(4)葡萄糖为单糖,在人体内氧化生成二氧化碳和水,释放能量.
解答 解:(1)饱和(NH4)2SO4溶液可使蛋白质发生盐析,故答案为:盐析;
(2)油脂在酶的作用下水解生成高级脂肪酸和甘油,故答案为:高级脂肪酸和甘油;
(3)氨基酸含有氨基和羧基,具有两性,氨基酸可与盐酸反应,故答案为:氨基;羧基;能;
(4)葡萄糖为单糖,在人体内氧化生成二氧化碳和水,释放能量,反应的化学方程式为:C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O,
故答案为:单;放出;C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O.
点评 本题综合考查有机物的结构和性质,侧重于糖类、油脂、蛋白质的考查,为高频考点,注意把握相关物质的性质以及应用,题目有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
16.下表列出了A~R等9种元素在周期表中的位置;
(1)写出下列元素的名称;A钠,C镁,E碳,R氩.
(2)D的原子结构示意图为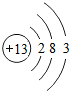 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素的原子半径由大到小的顺序为K>Na>Mg(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为KOH>NaOH>Mg(OH)2.(填化学式)
(4)F元素的氢化物的电子式为 ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(5)用电子式表示A与H形成化合物的过程为 ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D的原子结构示意图为
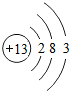 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.(3)A、B、C三种元素的原子半径由大到小的顺序为K>Na>Mg(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为KOH>NaOH>Mg(OH)2.(填化学式)
(4)F元素的氢化物的电子式为
 ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.(5)用电子式表示A与H形成化合物的过程为
 ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.
14.下列有关物质的性质与其应用不相对应的是( )
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
18.己烷雌酚的一种合成路线如图:
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 该反应为消去反应 | |
| D. | 化合物X中肯定有9个C原子共平面 |
15.下列有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 取用金属钠、钾时,未用完的钠、钾应放回原瓶 | |
| D. | 读取量筒内液体的体积,俯视读数会导致读数偏小 |
12.如表列出了前20号元素中的某些元素性质的一些数据:
(1)以上10种元素中,电负性最大的是O(填元素符号).
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为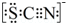 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
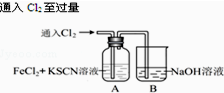 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
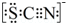 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.

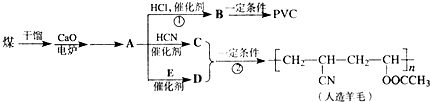
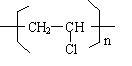 ,CH2C═CH-CN.
,CH2C═CH-CN.