题目内容
4.下列物质的电离方程式正确的是( )| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
分析 先判断强弱电解质,强电解质完全电离,用等号;弱电解质部分电离,用可逆号,多元弱酸分步电离,以第一步为主,离子团不能再拆,据此进行解答.
解答 解:A.碳酸为二元弱酸,电离方程式分别书写,主要写出第一步即可,正确的淀粉方程式为:H2CO3?H++HCO3-,故A错误;
B.氢氧化钡为强电解质,电离方程式应该用等号,正确的电离方程式为:Ba(OH)2=Ba2++2OH-,故B错误;
C.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,电离方程式应该为等号,正确的电离方程式为:NaHCO3=Na++HCO3-,故C错误;
D.次氯酸为弱酸,在溶液中部分电离出氢离子和次氯酸根离子,电离方程式为:HClO?H++ClO-,故D正确;
故选D.
点评 本题考查学生电离方程式的书写,题目难度不大,明确电解质的强弱是解题关键,注意多元弱酸分步电离,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
14.某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100mol•L-1稀盐酸和0.100mol•L-1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100mol•L-1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100mol•L-1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:①②④③或②①④③(填序号).
(2)测定过程中发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O.
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为250mL,理由是4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL.
(4)某同学四次测定的V数据如表:
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数60.0%.
(5)下列实验操作会引起测量结果偏低的是①②④⑤.
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
①配制0.100mol•L-1稀盐酸和0.100mol•L-1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100mol•L-1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100mol•L-1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:①②④③或②①④③(填序号).
(2)测定过程中发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O.
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为250mL,理由是4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL.
(4)某同学四次测定的V数据如表:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
(5)下列实验操作会引起测量结果偏低的是①②④⑤.
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
15.以NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,32gO2含2NA个原子 | |
| B. | 标准状况下,11.2LH2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含有NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为0.5 NA |
9.某学生用量筒量取液体,量筒放平稳后仰视液面读得数值为 19mL,倾倒部分液体后,又俯视液面,读得数值为10mL. 则该学生实际倾倒的液体体积是( )
| A. | 9mL | B. | 小于9mL | ||
| C. | 大于9 mL | D. | 因操作错误无法判断 |
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol苯乙烯(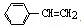 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
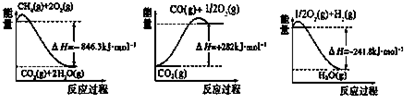
 .
. ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).