题目内容
19.如表为周期表的一部分,表中所列的字母分别代表一种化学元素.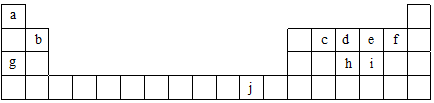
回答下列相关问题:
(1)写出元素f简单离子的结构示意图
 .
.(2)在c6a6分子中,元素c为sp2杂化,该分子是非极性分子(填“极性”或“非极性”).
(3)ci2分子的电子式为
 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).(4)第一电离能:h>i;电负性:g<b(填“>”、“<”或“=”).
分析 由元素在周期表的位置可知,a为H,b为Be,c为C,d为N,e为O,f为F,g为Na,h为P,i为S,j为Cu,
(1)f简单离子的质子数为9,核外电子数为10;
(2)c6a6分子为苯,苯为平面结构,C原子为sp2杂化,平面正六边形结构对称;
(3)ci2分子与二氧化碳结构相似,相对分子质量大的沸点高;
(4)P的3p电子半满为稳定结构,金属性越大,对应的电负性越小.
解答 解:由元素在周期表的位置可知,a为H,b为Be,c为C,d为N,e为O,f为F,g为Na,h为P,i为S,j为Cu,
(1)f简单离子的质子数为9,核外电子数为10,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)c6a6分子为苯,苯为平面结构,C原子为sp2杂化,平面正六边形结构对称,为非极性分子,故答案为:sp2;非极性;
(3)ci2分子与二氧化碳结构相似,ci2分子的电子式为 ,相对分子质量大的沸点高,ci2与ce2比较,沸点较高的是CS2,
,相对分子质量大的沸点高,ci2与ce2比较,沸点较高的是CS2,
故答案为: ;CS2;
;CS2;
(4)P的3p电子半满为稳定结构,金属性越大,对应的电负性越小,则第一电离能:h>i;电负性:g<b,故答案为:>;<.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、分子结构与性质为解答的关键,侧重分析与应用能力的考查,注意物质结构与性质的应用,(4)为解答的难点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
10.下列说法正确的是( )
| A. | 高锰酸钾充分加热后的剩余固体、碘酒、空气都是混合物 | |
| B. | Na2O和NH3的水溶液均能导电,故均为电解质 | |
| C. | 氧化还原反应中非金属单质只作氧化剂 | |
| D. | 酸碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应都可用H++OH-═H2O表示 |
7.互为同分异构体,且可用银镜反应区别的是( )
| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
11.下列金属的冶炼原理中,属于热分解法的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
8.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成2-甲基丙烯酸甲酯 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
9.下列叙述正确的是( )
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 浓度相等的CH3COOH溶液与NaOH溶液混合后显中性,c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |