题目内容
19.某密闭容器中,有A.B两种气体,反应按下式进行A(g)+B(g)?2C(g)反应经过2S后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.求:(1)B物质的起始浓度;
(2)2S时A的转化率;
(3)用物质A表示反应的平均速率;
(4)求该温度下此反应的平衡常数.
分析 (1)由方程式可知△c(B)=$\frac{1}{2}$△c(C),B的起始浓度=B的平衡浓度+△c(B);
(2)由方程式可知△c(A)=$\frac{1}{2}$△c(C),A的转化率=$\frac{A的浓度变化量}{A的起始浓度}$×100%;
(3)根据v=$\frac{△c}{△t}$计算v(A);
(4)根据K=$\frac{c(C){\;}^{2}}{c(A)c(B)}$计算.
解答 解:(1)由方程式可知△c(B)=$\frac{1}{2}$△c(C)=$\frac{1}{2}$×0.5mol/L=0.25mol/L,B的起始浓度=0.75mol/L+0.25mol/L=1mol/L,答:B物质的起始浓度1mol/L;
(2)由方程式可知△c(A)=$\frac{1}{2}$△c(C)=$\frac{1}{2}$×0.5mol/L=0.25mol/L,A的转化率=$\frac{0.25mol/L}{(0.5+0.25)mol/L}$×100%=33.3%,答:2S时A的转化率为33.3%;
(3)用A表示反应的平均速率v(A)=$\frac{0.25mol/L}{2s}$=0.125mol/(L.s),答:用物质A表示反应的平均速率为0.125mol/(L.s);
(4)K=$\frac{c(C){\;}^{2}}{c(A)c(B)}$=$\frac{0.5{\;}^{2}}{0.5×0.75}$=0.67,答:该温度下此反应的平衡常数为0.67.
点评 本题考查化学平衡计算,比较基础,旨在考查学生对基础知识的巩固,可以利用三段式进行计算解答.

练习册系列答案
相关题目
9.今有一种固体化合物X,X本身不导电,但熔融状态和溶于水时能够电离,下列关于X的说法中,不正确的是( )
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
4.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
11.全世界每年铜的产量为 8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2下列说法正确的是( )
| A. | Cu2S的摩尔质量为160 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中Cu2S既是氧化剂又是还原剂 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: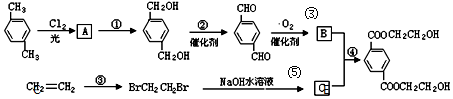
 、B、
、B、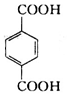 、C.HOCH2CH2OH、
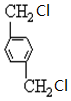
、C.HOCH2CH2OH、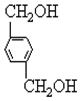 +2NaCl;
+2NaCl; ,反应的化学方程式是
,反应的化学方程式是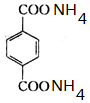 +2H2O.
+2H2O.