题目内容
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1mol苯乙烯(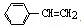 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
分析 A、苯环中不含碳碳双键;
B、标况下己烷为液态;
C、甲基中含9个电子;
D、乙炔和苯的最简式均为CH2.
解答 解:A、苯环中不含碳碳双键,故苯乙烯中含有一条双键,故1mol苯乙烯中含NA条碳碳双键,故A错误;
B、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、甲基中含9个电子,故1mol甲基中含9NA个电子,故C错误;
D、乙炔和苯的最简式均为CH2,故2.6g混合物中含有的CH的物质的量为0.2mol,故含0.2NA个碳原子,故D正确.
故选D.
点评 本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质结构特点是解题关键.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
3.化学反应Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3的反应类型是( )
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
4.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
6.开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正>v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是1.2mol•L-1.
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
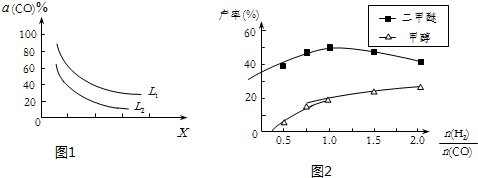
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件

(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
3.关于常温下pH=2的醋酸,下列叙述正确的是( )
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
10.下列说法正确的是( )
| A. | 高锰酸钾充分加热后的剩余固体、碘酒、空气都是混合物 | |
| B. | Na2O和NH3的水溶液均能导电,故均为电解质 | |
| C. | 氧化还原反应中非金属单质只作氧化剂 | |
| D. | 酸碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应都可用H++OH-═H2O表示 |
7.互为同分异构体,且可用银镜反应区别的是( )
| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
8.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成2-甲基丙烯酸甲酯 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |