题目内容
 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:2SO2(g)+O2(g)
| ||
| △ |
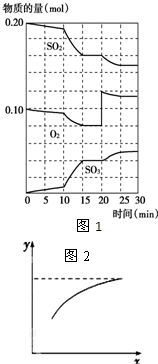
(1)600℃时,在一个体积为1L且恒容的密闭容器中,将二氧化硫和氧气混合发生反应,反应过程中SO2、O2、SO3物质的量的变化如图1所示:
①反应从0min 开始到第一次平衡时,二氧化硫的转化率为
②比较反应物SO2在10-15min和20-25min时平均反应速率的大小:v(10-15)
③计算在第18min时逆反应的平衡常数K=
④若上述反应达到平衡后,只改变一个条件(x),下列量(y)的变化一定符合如图2中曲线的是
| X | y | |
| A | 再加入SO2 | O2的转化率 |
| B | 再加入SO3 | SO2的体积分数 |
| C | 压强 | 混合气体的物质的量 |
| D | 温度 | 混合气体的平均摩尔质量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
A.a>2b;e>2fB.a=c;e=g C.a>d;e>h D.c+0.5Qe=Q
(3)工业制取硫酸是一个连续的生产过程.今测得进入接触室时混合气体(396K、40000kPa,主要成分为SO2、O2、N2)的流量为1.0m3/s,从接触室导出气体(792K、40000kPa)的流量为1.8m3/s,则导出气体中SO3所占的体积分数为
考点:化学平衡的计算
专题:
分析:(1)①根据图象判断第一次达到平衡时消耗二氧化硫的物质的量,再计算出其转化率;
②反应速率v=
,在10-15min和20-25min的时间变化相同,可以根据二氧化硫的物质的量变化判断v(10-15)、v(20-25)的大小;
③在第18min时处于平衡状态,根据图象数据计算出平衡时各组分的浓度,然后根据平衡常数的表达式及该反应方程式计算出其平衡常数;
④根据图2中曲线变化及化学平衡的影响因素进行解答;
(2)A、若将甲容器扩大为原来的2倍,则达平衡时甲与乙容器的浓度相等,但放出的热量是乙的2倍,现将甲容器再恢复为原来的体积,即加压,平衡向正反应方向移动;
B、甲容器起始时反应向正反应方向进行,而丙容器起始时反应向逆反应方向进行,反应热不同;
C、丁中氧气浓度增大,平衡向着正向移动,放出的热量增多;
D、根据平衡时甲中三氧化硫的物质的量计算出放出的热量,再根据甲和丙为反应方向相反的等效平衡进行判断;
(3)根据pV=nRT及气体物质的量与体积的关系判断反应前后气体物质的量变化,然后根据差量法计算出反应生成的三氧化硫的物质的量,再计算出其体积分数即可.
②反应速率v=
| △c |
| △t |
③在第18min时处于平衡状态,根据图象数据计算出平衡时各组分的浓度,然后根据平衡常数的表达式及该反应方程式计算出其平衡常数;
④根据图2中曲线变化及化学平衡的影响因素进行解答;
(2)A、若将甲容器扩大为原来的2倍,则达平衡时甲与乙容器的浓度相等,但放出的热量是乙的2倍,现将甲容器再恢复为原来的体积,即加压,平衡向正反应方向移动;
B、甲容器起始时反应向正反应方向进行,而丙容器起始时反应向逆反应方向进行,反应热不同;
C、丁中氧气浓度增大,平衡向着正向移动,放出的热量增多;
D、根据平衡时甲中三氧化硫的物质的量计算出放出的热量,再根据甲和丙为反应方向相反的等效平衡进行判断;
(3)根据pV=nRT及气体物质的量与体积的关系判断反应前后气体物质的量变化,然后根据差量法计算出反应生成的三氧化硫的物质的量,再计算出其体积分数即可.
解答:
解:(1)①根据图象曲线变化可知,第一次达到平衡时二氧化硫的物质的量为1.6mol,则二氧化硫的转化率为:
×100%=20%,
故答案为:20%;
②在10-15min和20-25min的时间变化都为5min,在10-15min二氧化硫的物质的量变化为0.4mol,而在在20-25min二氧化硫的物质的量变化小于0.2mol,根据反应速率v=
可知,v(10-15)一定大于v(20-25),
故答案为:>;
③第18min时该反应处于平衡状态,三氧化硫的浓度为:c(SO3)=
=0.4mol/L、c(SO2)=
=1.6mol/L、c(O2)=
=0.8mol/L,则该反应的逆反应为2SO3(g)?2SO2(g)+O2(g),其平衡常数为:K=
=1.28,
故答案为:1.28;
④图2中,随着x的增大,y逐渐增大,直至接近一个最大值,
A.加入二氧化硫后,可以氧气的转化率会增大,符合图象曲线变化,故A正确;
B.加入三氧化硫后,相当于增大了压强,平衡向着正向移动,则达到平衡时二氧化硫的含量减小,与图象不相符,故B错误;
C.增大压强后,平衡向着正向移动,混合气体的物质的量减小,故C错误;
D.升高温度,平衡向着逆向移动,混合气体的物质的量增大,则平均摩尔质量减小,故D错误;
故答案为:A;
(2)A、若将甲容器扩大为原来的2倍,则达平衡时甲与乙容器的浓度相等,但放出的热量甲是乙的2倍,现将甲容器再恢复为原来的体积,即加压,平衡向正反应方向移动,则放热又增多,故有a>2b;e>2f,故A正确;
B、甲和丙为等效平衡,则达到平衡时三氧化硫的浓度相等,即:e=g,但是甲容器起始时反应向正反应方向进行,而丙容器起始时反应向逆反应方向进行,虽然最后是等效平衡,但它们的转化率之和为100%,应该a+c=Q,但是a不一定等于c,故B错误;
C、丁中的O2可看作是在甲平衡后再充入1 mol O2,则平衡正向移动,放热增多,即有a<d,同时有e<h,故C错误;
D、根据反应:2SO2+O2=2SO3 △H=-QkJ?mol-1
2 Q
e a
解得a=0.5eQ,由选项B解析可知,a+c=Q,即0.5eQ+c=Q,故D正确;
故答案为:AD;
(3)由PV=nRT可知,反应后温度为反应前的两倍,则反应前流量1.0m3/s,在反应后条件下流量为:2.0m3/s;
反应后流量为1.8m3/s,根据V=nVm可知,反应后气体的物质的量相当于反应前的:
=0.9倍,设反应前为1mol的混合气体,反应后应该为0.9 mol,减少了0.1mol,则:
2SO2+O2?2SO3 减少的物质的量△n
2 1 2 2
0.2 mol 0.1 mol
故反应中共生成0.2 molSO3,导出气体中SO3所占的体积分数为:
=
,
故答案为:
.
| 2mol-1.6mol |
| 2mol |
故答案为:20%;
②在10-15min和20-25min的时间变化都为5min,在10-15min二氧化硫的物质的量变化为0.4mol,而在在20-25min二氧化硫的物质的量变化小于0.2mol,根据反应速率v=
| △c |
| △t |
故答案为:>;
③第18min时该反应处于平衡状态,三氧化硫的浓度为:c(SO3)=
| 0.4mol |
| 1L |
| 1.6mol |
| 1L |
| 0.8mol |
| 1L |
| 0.8×1.62 |
| 0.42 |
故答案为:1.28;
④图2中,随着x的增大,y逐渐增大,直至接近一个最大值,
A.加入二氧化硫后,可以氧气的转化率会增大,符合图象曲线变化,故A正确;
B.加入三氧化硫后,相当于增大了压强,平衡向着正向移动,则达到平衡时二氧化硫的含量减小,与图象不相符,故B错误;
C.增大压强后,平衡向着正向移动,混合气体的物质的量减小,故C错误;
D.升高温度,平衡向着逆向移动,混合气体的物质的量增大,则平均摩尔质量减小,故D错误;
故答案为:A;
(2)A、若将甲容器扩大为原来的2倍,则达平衡时甲与乙容器的浓度相等,但放出的热量甲是乙的2倍,现将甲容器再恢复为原来的体积,即加压,平衡向正反应方向移动,则放热又增多,故有a>2b;e>2f,故A正确;
B、甲和丙为等效平衡,则达到平衡时三氧化硫的浓度相等,即:e=g,但是甲容器起始时反应向正反应方向进行,而丙容器起始时反应向逆反应方向进行,虽然最后是等效平衡,但它们的转化率之和为100%,应该a+c=Q,但是a不一定等于c,故B错误;
C、丁中的O2可看作是在甲平衡后再充入1 mol O2,则平衡正向移动,放热增多,即有a<d,同时有e<h,故C错误;
D、根据反应:2SO2+O2=2SO3 △H=-QkJ?mol-1
2 Q
e a
解得a=0.5eQ,由选项B解析可知,a+c=Q,即0.5eQ+c=Q,故D正确;
故答案为:AD;
(3)由PV=nRT可知,反应后温度为反应前的两倍,则反应前流量1.0m3/s,在反应后条件下流量为:2.0m3/s;
反应后流量为1.8m3/s,根据V=nVm可知,反应后气体的物质的量相当于反应前的:
| 1.8 |
| 2 |
2SO2+O2?2SO3 减少的物质的量△n
2 1 2 2
0.2 mol 0.1 mol
故反应中共生成0.2 molSO3,导出气体中SO3所占的体积分数为:
| 0.2mol |
| 0.9mol |
| 2 |
| 9 |
故答案为:
| 2 |
| 9 |
点评:本题考查了化学平衡的计算,涉及化学反应速率、化学平衡常数的计算、化学平衡的影响因素、等效平衡的应用等知识,题目难度较大,计算量较大,知识点较多,注意掌握化学平衡及其影响,明确等效平衡的判断方法,试题充分考查的学生的分析、理解能力及化学计算能力.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
取100mL 0.3mol?L-1和300mL 0.1mol?L-1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A、0.21 mol?L-1 |
| B、0.56 mol?L-1 |
| C、0.24 mol?L-1 |
| D、0.12 mol?L-1 |
 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式: