题目内容
 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式:①镁与二氧化碳反应的化学方程式
②用H2SO4酸化的KI溶液放置在空气中发生反应的离子方程式
③草酸与酸性高锰酸钾溶液反应的离子方程式
(2)1g乙烷(C2H6)燃烧生成CO2和液态H2O时放出52kJ热量,写出表示乙烷燃烧热的热化学方程式
(3)用“*”标出下列分子中的手性碳原子.
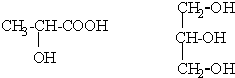
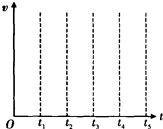
(4)工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.请在图中定性画出工业合成NH3中H2的逆反应速率(V)随时间(t)变化关系的图象.(其相应的变化特点为:t1达到平衡,t2增大压强,t3又达到平衡,t4降温,t5再次达到平衡.)
考点:化学方程式的书写,离子方程式的书写,有关反应热的计算,化学反应速率与化学平衡图象的综合应用
专题:化学用语专题,化学反应中的能量变化,化学平衡专题
分析:(1)①镁和二氧化碳发生置换反应生成氧化镁和碳;
②碘离子具有还原性,碘离子和氧气发生氧化还原反应生成碘;
③草酸与酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水;
(2)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;1g水蒸气转化成液态水放热2.5kJ,则H2O(l)=H2O(g)△H=+45kJ/mol,根据盖斯定律求解;
(3)根据手性碳原子连接四个不同的原子或原子团进行判断;
(4)根据不同时间段条件的变化画出H2的逆反应速率(V)随时间(t)变化关系的图象.
②碘离子具有还原性,碘离子和氧气发生氧化还原反应生成碘;
③草酸与酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水;
(2)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;1g水蒸气转化成液态水放热2.5kJ,则H2O(l)=H2O(g)△H=+45kJ/mol,根据盖斯定律求解;
(3)根据手性碳原子连接四个不同的原子或原子团进行判断;
(4)根据不同时间段条件的变化画出H2的逆反应速率(V)随时间(t)变化关系的图象.
解答:
解:(1)①镁为活泼金属,镁和二氧化碳发生置换反应2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
②碘离子和氧气发生氧化还原反应生成碘,离子反应为4I-+4H++O2=2I2+2H2O,故答案为:4I-+4H++O2=2I2+2H2O;
③草酸具有还原性与强氧化性酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(2)在25℃、101kPa下,1g乙烷燃烧生成CO2和液态水时放热52kJ,则30g乙烷完全燃烧生成二氧化碳和液态水放出的热量为30×52KJ=1560KJ,
则乙烷燃烧热的热化学方程式为:C2H6(g)+
O2(g)=2CO2(g)+3H2O(l)△H=-1560kJ/mol①,1g水蒸气转化成液态水放热2.5kJ,则②H2O(l)=H2O(g)△H=+45kJ/mol,由盖斯定律可知,①+②×3得到反应C2H6(g)+
O2(g)=2CO2(g)+3H2O(g)△H=-1425kJ/mol,则15g C2H6完全燃烧生成CO2和水蒸气时放出的热量为
=712.5KJ,
故答案为:C2H6(g)+
O2(g)=2CO2(g)+3H2O(l)△H=-1560kJ/mol; 712.5kJ;
(3)手性碳原子连接四个不同的原子或原子团,前者有手性碳原子,后者没有,
故答案为: ;
;
(4)t1达到平衡,则H2的逆反应速率(V)不变;t2降温,则H2的逆反应速率(V)降低;t3又达到平衡,H2的逆反应速率(V)不变;t4增大压强,H2的逆反应速率(V)增大;t5再次达到平衡,H2的逆反应速率(V)不变,据此画出图象,为 ,
,
故答案为: .
.
| ||
| ||
②碘离子和氧气发生氧化还原反应生成碘,离子反应为4I-+4H++O2=2I2+2H2O,故答案为:4I-+4H++O2=2I2+2H2O;
③草酸具有还原性与强氧化性酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(2)在25℃、101kPa下,1g乙烷燃烧生成CO2和液态水时放热52kJ,则30g乙烷完全燃烧生成二氧化碳和液态水放出的热量为30×52KJ=1560KJ,
则乙烷燃烧热的热化学方程式为:C2H6(g)+
| 7 |
| 2 |
| 7 |
| 2 |
| 1425KJ |
| 2 |
故答案为:C2H6(g)+
| 7 |
| 2 |
(3)手性碳原子连接四个不同的原子或原子团,前者有手性碳原子,后者没有,
故答案为:
 ;
;(4)t1达到平衡,则H2的逆反应速率(V)不变;t2降温,则H2的逆反应速率(V)降低;t3又达到平衡,H2的逆反应速率(V)不变;t4增大压强,H2的逆反应速率(V)增大;t5再次达到平衡,H2的逆反应速率(V)不变,据此画出图象,为
 ,
,故答案为:
 .
.
点评:本题考查较为综合,涉及离子反应方程式的书写、反应热的计算、手性碳原子、以图象的形式考查影响化学反应速率以及化学平衡移动的因素,题目难度中等,为高频考点,离子反应的书写注意把握发生的反应及离子反应的书写方法,注意反应实质的判断,注意盖斯定律应用、等效平衡问题.

练习册系列答案
相关题目
下列有机物中所有碳原子一定不可能处于同一平面上的是( )
| A、CH3CH2CH2CH2CH2CH3 |
| B、CH3CH2CH2CH2CH2COCH3 |
| C、CH2=CH-CH=CHCH3 |
| D、(CH3)3C-C≡C-C=CHCH3 |
下列变化属于吸热反应的是( )
①液态水气化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰
⑥水煤气反应
⑦二氧化碳与赤热的炭反应生成一氧化碳.
①液态水气化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰
⑥水煤气反应
⑦二氧化碳与赤热的炭反应生成一氧化碳.
| A、①④⑦ | B、②③⑥ |
| C、①④⑤ | D、②④⑥⑦ |
下列关于物理量的说法正确的是( )
| A、0.012kg C-12(12C)所含有的碳原子物质的量为1mol |
| B、SO42-的摩尔质量是 98 g?mol-1 |
| C、1 mol任何气体所占体积都约是22.4 L |
| D、阿伏加德罗常数等于6.02×1023 mol-1 |
下列有关水的说法错误的是( )
| A、水是氧化物 |
| B、煮沸可降低自来水的硬度 |
| C、肥皂水可区分硬水和软水 |
| D、电解水的实验,说明水是由氢气和氧气组成的 |
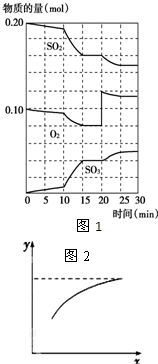 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为: