题目内容
根据信息试回答下列问题:
信息1:H2O是一种极弱的电解质,其电方程式为:H2O?OH-+H+
而碳化钙(CaC2)与水反应可以看作是一种复分解反应:CaC2+2H2O═Ca(OH)2+C2 H2↑
信息2:已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态.W是由两种常见元素组成,其与水的反应可类比碳化钙与水的反应.乙通常是一种红棕色粉末.G为白色胶状沉淀.W、G、H、I三种物质中都含有同一种常见金属元素.A是沼气的主要成分,与氧气完全反应时的体积比是1:2.各物质有如下图所示的转化关系(部分反应的产物未全部表示).

(1)I原子的结构示意图 .
(2)按要求写方程式:
I→E的离子方程式:
C→E的化学方程式:
(3)写出W和水反应的化学方程式
(4)取3mol F物质在一定条件下与足量水反应生成E,则此过程转移电子数目为 .
信息1:H2O是一种极弱的电解质,其电方程式为:H2O?OH-+H+
而碳化钙(CaC2)与水反应可以看作是一种复分解反应:CaC2+2H2O═Ca(OH)2+C2 H2↑
信息2:已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态.W是由两种常见元素组成,其与水的反应可类比碳化钙与水的反应.乙通常是一种红棕色粉末.G为白色胶状沉淀.W、G、H、I三种物质中都含有同一种常见金属元素.A是沼气的主要成分,与氧气完全反应时的体积比是1:2.各物质有如下图所示的转化关系(部分反应的产物未全部表示).

(1)I原子的结构示意图
(2)按要求写方程式:
I→E的离子方程式:
C→E的化学方程式:
(3)写出W和水反应的化学方程式
(4)取3mol F物质在一定条件下与足量水反应生成E,则此过程转移电子数目为
考点:无机物的推断
专题:推断题
分析:G为白色胶状沉淀,可能为Al(OH)3,A是沼气的主要成分,与氧气完全反应时的体积比是1:2,则A 为甲烷,W是由两种常见元素组成即铝和碳,其与水的反应可类比碳化钙与水的反应,则根据W与水反应生成CH4,所以W为Al4C3,因为A为CH4,燃烧生成的B为CO2,C为H2O,固体甲、E、I、F均为常见的单质,则甲为C,则D为CO,E为H2,乙通常是一种红棕色粉末,则固体乙为Fe2O3,则F为Fe,结合转化图可知,I为Al,H为NaAlO2,然后结合物质的性质及化学用语来解答.
解答:
解:G为白色胶状沉淀,可能为Al(OH)3,A是沼气的主要成分,与氧气完全反应时的体积比是1:2,则A 为甲烷,W是由两种常见元素组成即铝和碳,其与水的反应可类比碳化钙与水的反应,则根据W与水反应生成CH4,所以W为Al4C3,因为A为CH4,燃烧生成的B为CO2,C为H2O,固体甲、E、I、F均为常见的单质,则甲为C,则D为CO,E为H2,乙通常是一种红棕色粉末,则固体乙为Fe2O3,则F为Fe,结合转化图可知,I为Al,H为NaAlO2.
(1)I为Al,其原子的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)I→E为铝与NaOH溶液的反应生成偏铝酸钠、水和氢气,离子方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;C→E为C和水反应生成CO和氢气,化学方程式为:C+H2O
CO+H2;故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;C+H2O
CO+H2;
(3)W和水反应的化学方程式为Al4C3+12H2O=3CH4↑+4Al(OH)3 ↓,故答案为:Al4C3+12H2O=3CH4↑+4Al(OH)3 ↓;
(4)F物质在一定条件下与足量水反应生成E,即铁与水反应在高温下生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
Fe3O4+4H2,则根据方程式取3mol 铁参与反应生成了4mol氢气,根据生成1mol氢气转移2mol电子,所以4mol氢气转移8mol电子,故答案为:8×6.02×1023;
(1)I为Al,其原子的结构示意图为
 ,故答案为:
,故答案为: ;
;(2)I→E为铝与NaOH溶液的反应生成偏铝酸钠、水和氢气,离子方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;C→E为C和水反应生成CO和氢气,化学方程式为:C+H2O
| ||
| ||
(3)W和水反应的化学方程式为Al4C3+12H2O=3CH4↑+4Al(OH)3 ↓,故答案为:Al4C3+12H2O=3CH4↑+4Al(OH)3 ↓;
(4)F物质在一定条件下与足量水反应生成E,即铁与水反应在高温下生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
| ||
点评:本题考查无机物的推断“无机框图推断题”作为一种高考的题型,它有明显的学科特点,不仅考查学生对元素及其化合物主干知识掌握的情况,更能考查思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力.这类题型的主要特点是:结构紧凑、文字表述少,包含信息多、综合性强,思维能力要求高,具有很高的区分度和很好的选拔功能,最关键的是寻找“突破口”!

练习册系列答案
相关题目
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中R与T原子序数之和为20,下列判断正确的是( )
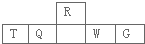

| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
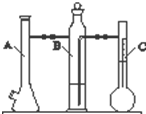 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
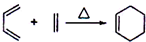 ; ii)CH2=CHCH3
; ii)CH2=CHCH3