题目内容
材料2:化合物K4Fe(C2O4)y?zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成.
→溶解蒸发→冷却结晶→操作Ⅲ→重结晶→干燥→K4Fe(C2O4)y?zH2O
Ⅰ.制备:
(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是
(2)操作Ⅲ的名称是
Ⅱ.组成测定:称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O4 2-完全转化为H2C2O4后,用0.10mol?L-1 KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好完全反应:再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
(3)配制250mL0.10mol?L-1 KMnO4 溶液及上述滴定实验中,所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶还有 和 .两个滴定中到达终点时溶液颜色为 色,且30秒内不变色.
(4)通过计算,求此光敏材料的化学式 .
|
Ⅰ.制备:
(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是
(2)操作Ⅲ的名称是
Ⅱ.组成测定:称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O4 2-完全转化为H2C2O4后,用0.10mol?L-1 KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好完全反应:再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
(3)配制250mL0.10mol?L-1 KMnO4 溶液及上述滴定实验中,所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶还有
(4)通过计算,求此光敏材料的化学式
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:I.(1)由题目信息可知,化合物KxFe(C2O4)y?zH2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解;
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯;
Ⅱ.(3)题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管,关键是要准确写出“250mL容量瓶”.而KMnO4溶液有强氧化性,需用酸式滴定管盛放.终点颜色的判断,需要准确理解该滴定实验的原理,该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色;
(4)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-),由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知n(C2O42-)=
n(MnO4-),根据化学式,可求得y的值,根据化合价代数和为0计算xx的值,由铁元素守恒可知,化合物KxFe(C2O4)y?zH2O等于Fe3+的物质的量,计算该化合物摩尔质量,进而计算z的值,据此书写化学式.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯;
Ⅱ.(3)题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管,关键是要准确写出“250mL容量瓶”.而KMnO4溶液有强氧化性,需用酸式滴定管盛放.终点颜色的判断,需要准确理解该滴定实验的原理,该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色;
(4)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-),由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知n(C2O42-)=
| 5 |
| 2 |
解答:
解:I.(1)由题目信息可知,化合物KxFe(C2O4)y?zH2O(Fe为+3价)是一种光敏感材料,可知黑暗是为了防止晶体见光分解,
故答案为:黑暗可以防止晶体分解.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯,
故答案为:过滤、洗涤;
Ⅱ.(3)配制250mL 0.10mol?L-1KMnO4溶液,由已有的仪器可知,还需要250mL容量瓶;
由已有的仪器可知,滴定实验还需要滴定管,KMnO4溶液有强氧化性,可以发生橡皮管,需用酸式滴定管盛放;
该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色,30秒内不变色,
故答案为:250mL容量瓶;酸式滴定管; 紫红;
(4)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-)=5×0.002L×0.10mol?L-1=0.001mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知,n(C2O42-)=
n(MnO4-)=
×0.012L×0.10mol?L-1=0.003mol,所以0.001mol:0.003mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁元素守恒可知,化合物KxFe(C2O4)y?zH2O等于Fe3+的物质的量为0.001mol,所以计算该化合物摩尔质量为
=491g/mol,所以得到:3×39+56+3×88+18z=491,
解得z=3,故该化合物的化学式为K3Fe(C2O4)3?3H2O,
故答案为:K3Fe(C2O4)3?3H2O.
故答案为:黑暗可以防止晶体分解.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯,
故答案为:过滤、洗涤;
Ⅱ.(3)配制250mL 0.10mol?L-1KMnO4溶液,由已有的仪器可知,还需要250mL容量瓶;
由已有的仪器可知,滴定实验还需要滴定管,KMnO4溶液有强氧化性,可以发生橡皮管,需用酸式滴定管盛放;
该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色,30秒内不变色,
故答案为:250mL容量瓶;酸式滴定管; 紫红;
(4)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-)=5×0.002L×0.10mol?L-1=0.001mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知,n(C2O42-)=
| 5 |
| 2 |
| 5 |
| 2 |
| 0.491g |
| 0.001mol |
解得z=3,故该化合物的化学式为K3Fe(C2O4)3?3H2O,
故答案为:K3Fe(C2O4)3?3H2O.
点评:本题考查学生对工艺流程理解、阅读获取信息能力、溶液配制、氧化还原反应滴定与计算等,难度中等,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.

练习册系列答案
相关题目
下列各项表达正确的是( )
| A、NaH是离子化合物,则NaH的电子式为Na:H |
| B、碘-131是一种放射性元素,其简单阴离子的核外电子数为53 |
| C、等物质的量的HCl和NaCl中分子数相等 |
| D、核素A与核素B的质量数相等,中子数不相等,它们一定不是同位素 |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中R与T原子序数之和为20,下列判断正确的是( )


| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
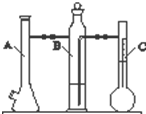 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.

