题目内容
12.(1)向200mL NaOH溶液中投入5.4gAl,二者恰好完全反应,参加反应的NaOH的物质的量浓度1mol/L,生成标况下氢气的体积6.72L.(2)从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4.(已知FeS2中Fe显+2价)还原剂是FeS2(填化学式),Cu2S是还原产物(选填“还原剂、氧化剂、还原产物、氧化产物或非氧化还原产物”),当有5mol FeS2发生反应时,有21mol电子转移.
(3)在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH溶液,得到1.56g沉淀,NaOH溶液的物质的量浓度0.6mol/L或1.8mol/L.
分析 (1)发生2NaOH+2Al+2H2O=2NaAlO2+3H2↑,结合反应及n=$\frac{m}{M}$、V=nVm计算;
(2)反应中Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价;
(3)1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,n(AlCl3)=0.05mol,氯化铝有剩余或恰好完全反应,碱不足只发生Al3++3OH-═Al(OH)3↓,碱过量发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.
解答 解:(1)n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,由2NaOH+2Al+2H2O=2NaAlO2+3H2↑,n(NaOH)=0.2mol,n(H2)=0.3mol,则参加反应的NaOH的物质的量浓度$\frac{0.2mol}{0.2L}$=1mol/L,生成标况下氢气的体积0.3mol×22.4L/mol=6.72L,故答案为:1mol/L;6.72L;
(2)在反应中14CuSO4+5FeS2+l2H2O═7Cu2S+5FeSO4+12H2SO4,Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,Cu元素化合价降低,被还原,CuSO4为氧化剂,Cu2S是还原产物,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价,则FeS2既为氧化剂又为还原剂,Cu2S是还原产物,5molFeS2和14molCuSO4正好反应,反应过程中Cu得电子:14×1 mol=14 mol,S得电子:7×1 mol=7 mol,S失电子:3×7 mol=21 mol,反应中电子转移了21 mol;则当有5mol FeS2发生反应时,转移电子为21mol,
故答案为:FeS2;还原产物;21;
(3)1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,n(AlCl3)=0.05mol,
碱不足时,由Al3++3OH-═Al(OH)3↓可知,n(NaOH)=0.06mol,c(NaOH)=$\frac{0.06mol}{0.1L}$=0.6mol/L;
若碱过量,则
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3+OH-═AlO2-+2H2O
0.03mol 0.03mol
则n(NaOH)=0.15mol+0.03mol=0.18mol,
c(NaOH)=$\frac{0.18mol}{0.1L}$=1.8mol/L,
故答案为:0.6mol/L或1.8mol/L.
点评 本题考查氧化还原反应及物质的量浓度的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | SO2 | B. | Cl2 | C. | Na2O2 | D. | NaClO |
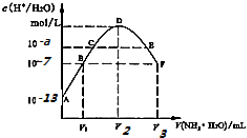
| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |


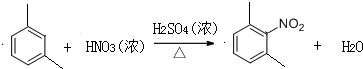 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
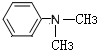 (写结构简式).
(写结构简式).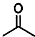 ,则键线式为
,则键线式为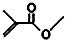 的物质的分子式为C5H8O2.
的物质的分子式为C5H8O2.
 .M+>N3+>H+
.M+>N3+>H+