题目内容
4.相等物质的量的金属Mg和Al分别跟足量盐酸反应,所产生的氢气其体积(同温同压)之比为( )| A. | 1:2 | B. | 2:3 | C. | 8:9 | D. | 1:1 |
分析 盐酸足量,Mg、Al均完全反应,金属失去电子之比等于生成氢气的物质的量比,同温同压下,物质的量比等于气体的体积比,以此计算.
解答 解:盐酸足量,Mg、Al均完全反应,金属失去电子之比等于生成氢气的物质的量比,同温同压下,物质的量比等于气体的体积比,
设金属均为1mol,则所产生的氢气其体积(同温同压)之比为1mol×(2-0):1mol×(3-0)=2:3,
故选B.
点评 本题考查化学反应的计算,为高频考点,把握盐酸足量及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
9.验证某有机物是由C、H、O三种元素组成的烃的衍生物,应完成的实验内容是( )
| A. | 测定它的碳、氢元素的质量比 | |
| B. | 只要证明它完全燃烧后产物有H2O和CO2 | |
| C. | 测定其产物中H2O和CO2的比值 | |
| D. | 测定该试样质量及试样完全燃烧后产物的质量 |
16.利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理.
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为2Al+OH-+NO2-+2H2O═2AlO2-+NH3•H2O
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
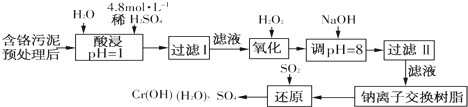
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可)(至少写一条).
(2)调pH=8是为了除去Fe3+、Al3+(填Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Mg2+、Ca2+(填Fe3+、Al3+、Ca2+、Mg2+).
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;
每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol.
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu).
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为2Al+OH-+NO2-+2H2O═2AlO2-+NH3•H2O
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)调pH=8是为了除去Fe3+、Al3+(填Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Mg2+、Ca2+(填Fe3+、Al3+、Ca2+、Mg2+).
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;
每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol.
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu).
13.常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
 如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题: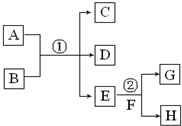 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题: