题目内容
1.由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):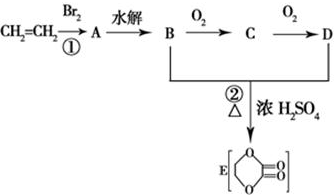
请分析后回答下列问题:
(1)反应的类型分别是①加成反应、②酯化反应或取代反应;
(2)D物质中的官能团为-COOH;
(3)C物质的结构简式OHC-CHO;
(4)物质X与A互为同分异物体,则X的结构简式为CH3-CHBr2,
(5)A→B的化学方程式(注明反应条件)BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.
分析 CH2=CH2和溴发生加成反应,生成A为CH2BrCH2Br,A水解生成B为CH2OHCH2OH,B发生氧化反应,其氧化产物C为OHC-CHO,进而被氧化为D,D为HOOC-COOH,B和D发生酯化反应生成E,据此分析解答.
解答 解:CH2=CH2和溴发生加成反应,生成A为CH2BrCH2Br,A水解生成B为CH2OHCH2OH,B发生氧化反应,其氧化产物C为OHC-CHO,进而被氧化为D,D为HOOC-COOH,B和D发生酯化反应生成E,
(1)通过以上分析知,反应的类型分别是①加成反应、②是酯化反应或取代反应,
故答案为:加成反应;酯化反应或取代反应;
(2)D为HOOC-COOH,D物质中的官能团为-COOH,故答案为:-COOH;
(3)通过以上分析知,C物质的结构简式OHC-CHO,故答案为:OHC-CHO;
(4)A为CH2BrCH2Br,对应的同分异构体为CH3-CHBr2,故答案为:CH3-CHBr2;
(5)A水解反应的化学方程式为:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr,
故答案为:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,知道常见官能团反应类型,注意结合条件分析解答,题目难度不大.

练习册系列答案
相关题目
9.验证某有机物是由C、H、O三种元素组成的烃的衍生物,应完成的实验内容是( )
| A. | 测定它的碳、氢元素的质量比 | |
| B. | 只要证明它完全燃烧后产物有H2O和CO2 | |
| C. | 测定其产物中H2O和CO2的比值 | |
| D. | 测定该试样质量及试样完全燃烧后产物的质量 |
16.利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理.
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为2Al+OH-+NO2-+2H2O═2AlO2-+NH3•H2O
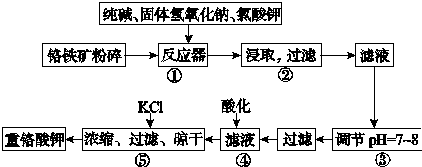
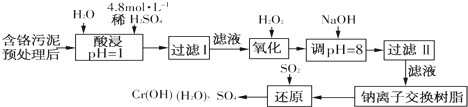
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可)(至少写一条).
(2)调pH=8是为了除去Fe3+、Al3+(填Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Mg2+、Ca2+(填Fe3+、Al3+、Ca2+、Mg2+).
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;
每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol.
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu).
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为2Al+OH-+NO2-+2H2O═2AlO2-+NH3•H2O
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)调pH=8是为了除去Fe3+、Al3+(填Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Mg2+、Ca2+(填Fe3+、Al3+、Ca2+、Mg2+).
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;
每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol.
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu).
6.铵盐是一类重要的氮的化合物,设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 mol NH4+含有的电子数为11NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键 |
13.常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
10.下列说法正确的是( )
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I? |