题目内容
11.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为20%、40%、40%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )| A. | m=2 | |
| B. | 两次平衡的平衡常数相同,平衡常数值为2 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为1.0 mol•L-1 |
分析 A.反应:X(g)+m Y(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为20%、40%、40%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,可知m=2;
B.平衡常数只与温度有关;
C.加入1molX(g)和2molY(g),与化学计量数的比值相同;
D.X(g)+2 Y(g)?3Z(g)
开始 1 2 0
转化 x 2x 3x
平衡1-x 2-2x 3x
$\frac{1-x}{1-x+2-2x+3x}$=20%,解得x=0.4
则Z的平衡浓度为$\frac{0.4mol×3}{2L}$=0.6mol/L,
由极限转化可知,若开始投入3molZ时平衡浓度为0.6mol/L,体积不变时物质的量增大,浓度增大.
解答 解:A.反应:X(g)+m Y(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为20%、40%、40%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,则该反应为体积不变的反应,1+m=3,可知m=2,故A正确;
B.平衡常数只与温度有关,则两次平衡的平衡常数相同,
X(g)+2 Y(g)?3Z(g)
开始 1 2 0
转化 x 2x 3x
平衡1-x 2-2x 3x
$\frac{1-x}{1-x+2-2x+3x}$=20%,解得x=0.4
K=$\frac{(0.6)^{3}}{0.3×(0.6)^{2}}$=2,故B正确;
C.加入1molX(g)和2molY(g),与化学计量数的比值相同,则X与Y的平衡转化率之比为1:1,故C正确;
D.X(g)+2 Y(g)?3Z(g)
开始 1 2 0
转化 x 2x 3x
平衡1-x 2-2x 3x
$\frac{1-x}{1-x+2-2x+3x}$=20%,解得x=0.4
则Z的平衡浓度为$\frac{0.4mol×3}{2L}$=0.6mol/L,
由极限转化可知,若开始投入3molZ时平衡浓度为0.6mol/L,体积不变时物质的量增大,浓度增大,再加入1molZ,$\frac{3}{0.6mol/L}=\frac{4}{c(Z)}$,则c(Z)=0.8mol/L,故D错误;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,题目难度不大.

| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
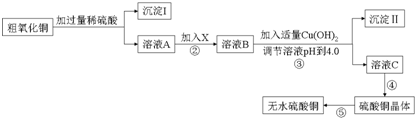
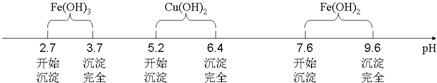
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
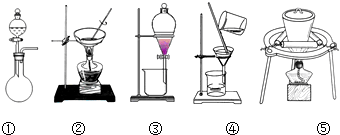
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)
(2)物质X应选用②(填序号)
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩 冷却结晶、过滤、自然干燥.
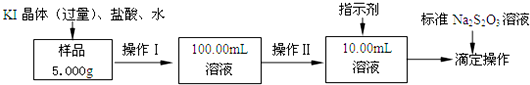
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
(已知2Cu2++4I-=2CuI↓+I2)
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-═2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
②溶液A中c(Cu2+)=0.5000mol/L.
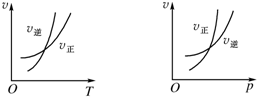 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |