题目内容
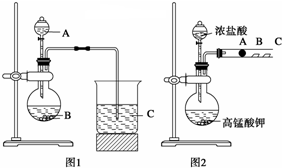
8. 某同学欲利用图装置验证同主族元素性质递变规律.
某同学欲利用图装置验证同主族元素性质递变规律.若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为溶液变为蓝色,反应离子方程式为Cl2+2I-═2Cl-+I2,即可证明.
分析 KMnO4与浓盐酸反应生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色.
解答 解:KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,故C中溶液变为蓝色,
氯气与淀粉碘化钾混合溶液反应离子方程式为:Cl2+2I-═2Cl-+I2,则证明了非金属性:Cl>I,
故答案为:溶液变为蓝色;Cl2+2I-═2Cl-+I2;
点评 本题考查实验方案设计,涉及非金属性强弱的比较、离子方程式书写等,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
15.甲烷的一种氟化物的化学式是CH3F,下列说法正确的是( )
| A. | 甲烷与氟气发生取代反应可以制得CH3F | |
| B. | CH3F分子中含有离子键 | |
| C. | CH3F分子中含有共价键和离子键 | |
| D. | CH3F的摩尔质量是34 |
16.如图为反应H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法不正确的是( )
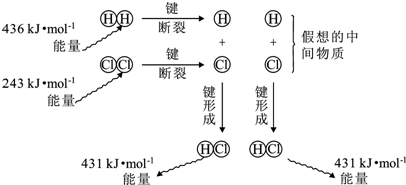

| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
3.下列有关物质性质的说法正确的是( )
| A. | 热稳定性:HCl<HBr<HI | B. | 原子半径:K<Na<Li | ||
| C. | 熔点:Cl2>Br2>I2 | D. | 氧化性:Cl2>Br2>I2 |
13.碘酸钙[Ca(IO3)2]是-种食品添加剂,以KCLO3、I2为原料,采用如下图所示的流程可制备碘酸钙.
下列有关说法正确的是( )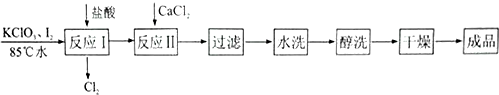
下列有关说法正确的是( )

| A. | “反应I”中主要反应的离子方程式为CIO3-+5CL-+6H+=3CL2↑+3H20 | |
| B. | “反应I”适宜在水浴加热的条件下进行 | |
| C. | 进行“反应Ⅱ”之前需向溶液中滴加过量K2C03溶液除去其中的盐酸 | |
| D. | “醇洗”的目的是为了除去产品中某些不溶性杂质 |
20.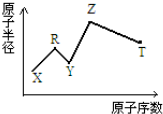 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 简单的气态氢化物的沸点和稳定性排序均为:Y>T | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
17.2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)是制备硫酸的重要反应.下列叙述中,正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |