题目内容
3.下列有关物质性质的说法正确的是( )| A. | 热稳定性:HCl<HBr<HI | B. | 原子半径:K<Na<Li | ||
| C. | 熔点:Cl2>Br2>I2 | D. | 氧化性:Cl2>Br2>I2 |
分析 A.非金属性越强,对应氢化物越稳定;
B.同主族从上到下原子半径增大;
C.由分子构成的同类型物质,相对分子质量越大,熔沸点越大;
D.非金属性越强,对应单质的氧化性越强.
解答 解:A.非金属性越强,对应氢化物越稳定,则热稳定性:HCl<HBr>HI,故A错误;
B.同主族从上到下原子半径增大,则原子半径:K>Na>Li,故B错误;
C.由分子构成的同类型物质,相对分子质量越大,熔沸点越大,则熔点:Cl2<Br2<I2,故C错误;
D.非金属性越强,对应单质的氧化性越强,则氧化性:Cl2>Br2>I2,故D正确;
故选D.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.物质的转化在给定条件下能实现的是( )
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | B. | CuCl2$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu | ||
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | D. | Al2O3(s)$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{通电}{→}$Al(s) |
18.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
则表中x为( )
| O═O | H-H | H-O(g) | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 920 | B. | 557 | C. | 463 | D. | 188 |
 某同学欲利用图装置验证同主族元素性质递变规律.
某同学欲利用图装置验证同主族元素性质递变规律.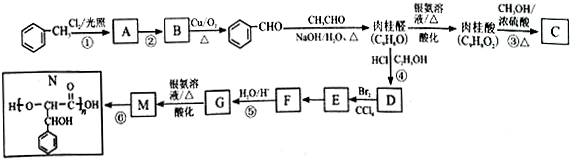
 .
. .
. .
.