题目内容
6. 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是BC.
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变
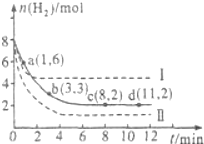
(2)一定温度下,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)代表的意思是:在1min时H2的物质的量是6mol.
①a点正反应速率大于 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)=0.83mol•L-1min-1.
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是升高温度,曲线II对应的实验条件改变是增大压强.
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+.
分析 (1)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(2)①根据图象中氢气的物质的量变化判断反应进行的方向,然后判断正逆反应速率大小;v=$\frac{△c}{△t}$进行计算求解;
②曲线Ⅰ的反应速率大于原反应,达到平衡时氢气的物质的量增大,说明平衡向着逆向移动;曲线Ⅱ的反应速率大于原反应,达到平衡时氢气的物质的量减小,说明平衡向着正向移动;
(3)燃料电池中,负极上燃料失电子发生氧化反应.
解答 解:(1)A.平衡时各物质物质的量之比决定于开始加入物质的多少和反应限度,与平衡状态无关,所以n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1,不能判断正逆反应速率是否相等,无法判断是否达到平衡状态,故A错误;
B.该反应是体积减小的反应,容器内压强保持不变,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C.当H2的消耗速率与CH3OH的消耗速率之比为3:1时才能表示正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C正确;
D.容器内的密度保持不变,反应方程式两边都是气体,气体的总质量不变,容器的容积固定,所以反应过程中气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选BC;
(2)①根据图象可知,a到b过程中氢气的物质的量减小,说明反应向着正向移动,正反应速率大于逆反应速率,v=$\frac{△c}{△t}$=$\frac{\frac{8-3}{2}}{3}$=0.83mol•L-1min-1,
故答案为:大于; 0.83mol•L-1min-1;
②由曲线Ⅰ的反应速率增大,且达到平衡时氢气的物质的量增大,平衡向着逆向移动,该反应为放热反应,说明升高了温度,正逆反应速率都增大,平衡向着逆向移动,氢气的转化率减小;
根据曲线Ⅱ的曲线可知,反应速率比原反应增大,达到平衡时氢气的物质的量减小,平衡向着正向移动,该反应是体积缩小的反应,说明增大了压强,正逆反应速率都增大,平衡性在正向移动,氢气的转化率增大,
故答案为:升高温度;增大压强;
(3)燃料电池中,负极上燃料失电子发生氧化反应,所以负极反应式为:CH3OH+H2O-6e-=CO2↑+6H+,故答案为:CH3OH+H2O-6e-=CO2↑+6H+.
点评 本题考查了化学平衡状态的判断、原电池电极反应式书写、化学平衡的计算等知识,题目难度较大,涉及的知识点较多,充分考查了学生对书写知识的掌握情况.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验操作 | 实验目的 |
| A | 在ZnS的白色浊液中滴几滴CuSO4溶液 | 探究Ksp(ZnS)和Ksp(CuS)的相对大小 |
| B | 用pH试纸分别测定等浓度的NaF、NaClO溶液的pH | 探究HF与HClO的电离常数 |
| C | 取少量硝酸亚铁溶液,滴加盐酸和KSCN溶液 | 探究硝酸亚铁是否变质 |
| D | 在CH2=CHCH2OH中滴加酸性高锰酸钾溶液,振荡 | 检验丙烯醇是否具有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
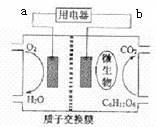
| A. | 微生物促进了反应中电子的转移 | |
| B. | 连接a的电极为负极 | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ |
| A. | Cu(OH)2 | B. | CuSO4•5H2O | C. | CuSO4 | D. | CuO |
| A. | CH3-CH═CH-CH3 二丁烯 | B. | 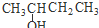 2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3OOCC2H5 乙酸乙酯 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
| A. | MgSO4 | B. | Al(NO3)3 | C. | CuSO4 | D. | Na2SO4 |
| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |